
【题目】下列图示与对应的叙述相符的是( )
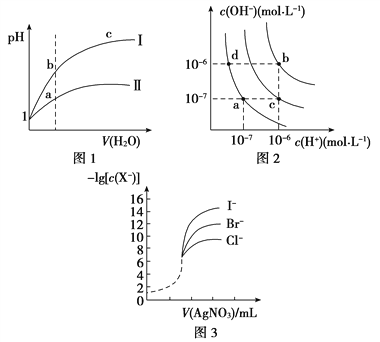
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
【答案】C
【解析】试题分析:A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,当开始时二者的pH相同,溶液中c(H+)相等,随着加水稀释,醋酸的电离平衡正向移动,使稀释过程中醋酸溶液中c(H+)大于盐酸,所以稀释相同倍数时盐酸的pH变化较大,醋酸的pH变化较小,溶液中离子浓度越大,溶液的导电性就越强,因此反应图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为醋酸,且a点溶液的导电性比b点强,错误;B.水的电离过程是吸热过程,升高温度,促进水的电离,水电离产生的c(H+)、c(OH-)都增大,若是纯水仅升高温度,就可以从a点变到b点,而若从a点变为c点,则还要加入强酸,不是仅升高温度实现,错误;C.图2中在b点对应温度下,Kw=1.0×10-12;将pH=2的H2SO4,c(H+)=10-2mol/L与pH=10的NaOH溶液,c(OH-)=10-2mol/L,二者等体积混合后,则溶液中c酸·V酸=c碱·V碱,n(H+)=n(OH-)所以溶液显中性,正确;D.根据图示可知,AgCl的溶解度最大,AgI的溶解度最小,所以用0. 0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,可确定首先沉淀的是I-,错误。


科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.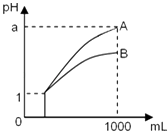
A.①④
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,设计了如下实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应的速率最慢;_____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明C1的非金属性比S强,反应的离子方程式为:_______________。
II.利用下图装置可验证同主族非金属性的变化规律。

(3)仪器B的名称为__________,干燥管D的作用为___________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液_____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液______的现象,即可证明。但有的同学认为盐酸具有挥发性,应用______溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.实验用过的药品可以不经过处理直接丢弃
B.易分解实验药品应存放在无色玻璃瓶中
C.凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂.
D.实验室制备有毒有害气体需要在通风橱中进行,必须对尾气进行吸收或处理,防止中毒或污染大气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,设计了如下实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应的速率最慢;_____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______________。
II.利用下图装置可验证同主族非金属性的变化规律。
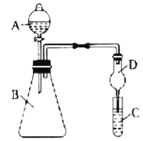
(3) 仪器A的名称为__________, B为__________,干燥管D的作用为___________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液_____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液______的现象,即可证明。但有的同学认为盐酸具有挥发性,应用______溶液除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com