
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.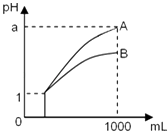
A.①④
B.②③
C.①③
D.②④
【答案】C
【解析】①pH=1的酸,加水稀释到1000倍,若pH=4,为强酸,若a<4,则A、B 都是弱酸,①符合题意;
②由图可知,B的pH小,c(H+)大,则B酸的酸性强,②不符合题意;
③由图可知,若a=4,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,③符合题意;
④因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),则A、B两种酸溶液的物质的量浓度不一定相等,④不符合题意;
所以答案是:C.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)

A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 写出该反应的离子方程式 .
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是 .
A.﹣1
B.+1
C.+3
D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式 .
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为kJ.
(5)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为: .
②上述反应中,正反应速率为υ正=k正x2(HI),逆反应速率为υ逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母).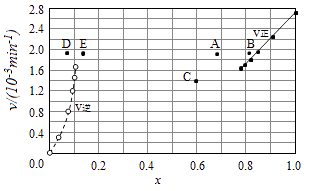
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )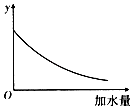
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液中醋酸的物质的量浓度
D.醋酸的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色济液中,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,试回答下列问题:

(1)该溶液中一定不存在的阴离子有_______。
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为_______________________________。
(3)原得液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)实验所加的NaOH溶液的浓度为________。
(5)溶液中存在一种不能确定的阳离子,请设计实验方案加以检验_________________________。
(6)原溶液中NO3-的浓度为c(NO3-)则c(NO3-)的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子.X和Y所形成的稳定化合物的摩尔质量为( )
A.148gmol﹣1
B.100gmol﹣1
C.90gmol﹣1
D.38gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
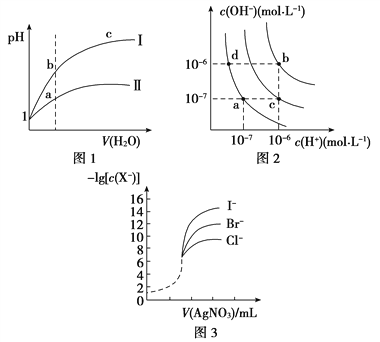
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com