
【题目】25℃时,0.1mol/L稀醋酸加水稀释,如图中的纵坐标y可以是( )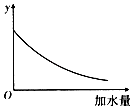
A.溶液的pH
B.醋酸的电离平衡常数
C.溶液中醋酸的物质的量浓度
D.醋酸的电离程度
【答案】C
【解析】A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,A不符合题意;
B.温度不变,醋酸的电离平衡常数不变,B不符合题意;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,醋酸溶液的物质的量浓度逐渐减小,C符合题意;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,D不符合题意;
所以答案是:C.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。
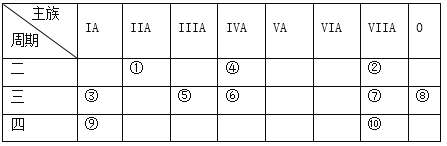
针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在①~⑩元素中,金属性最强的元素是_______,最活泼的非金属元素是__________。
(2)化学性质最不活泼的元素是________,其原子的原子结构示意图为_________________。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是___________,呈两性的氢氧化物是____________。
(4)在②、③、⑤元素形成的简单离子中,离子半径最大的是________。
(5)在⑦与⑩的单质中,化学性质较活泼的是______,可用什么化学反应说明该事实(写出反应的化学方程式):___________________________。
(6)由③和⑦组成的化合物,溶于水制成饱和溶液,用石墨为电极电解该溶液,请写出阳极电极反应式_________________________ ,阴极产物(填化学式)是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | NaOH | H2SO4 | BaCO3 | SO2 | CO2 |
B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HClO | CaCO3 | CaO | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2 , 将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.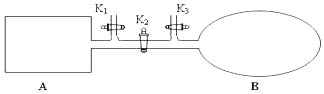
(1)B中除了可通过观察混合气颜色不变的现象判断可逆反应2NO2N2O4已经达到平衡外,还可通过的现象进行判断.
(2)若平衡后在A容器中再充入0.5molNO2 , 则重新到达平衡,新平衡与旧平衡相比,下列物理量减小的有;
A.c(NO2) B.NO2的体积分数 C.NO2的转化率 D. ![]()
若平衡后在B容器中再充入0.5mol NO2 , 则重新到达平衡,新平衡与旧平衡相比,下列物理量增大的有 .
A.NO2的转化率 B.混合气体的平均相对分子质量 C. ![]() D.n(NO2)
D.n(NO2)
(3)若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率υ(NO2)等于 .
(4)若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 | 需除杂的物质 | 试剂 | 操作 |
A | NaCl(Na2CO3) | 稀盐酸 | 蒸发结晶 |
B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | CO2(CO) | ﹣﹣ | 点燃 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.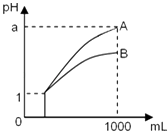
A.①④
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素形成的化合物丰富多彩,试回答下列问题:
(1)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体。
①基态铜原子的核外电子排布式为________________;
②1mol该蓝色晶体的阳离子中含有的σ键的数目为___________;
③简要解释为什么加入乙醇会有晶体析出_____________________________;
(2)已知邻羟基苯胺的结构式为![]() ,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为
,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为![]() ,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为
,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为![]() ,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
(3)已知CuN3中的阴离子与CO2互为等电子体,CuN3晶体的晶胞与氯化钠的晶胞类似。
①请写出CuN3中的阴离子的电子式__________________;
②已知该晶体晶胞边长a,b,c,关系为a=b___________个;
(4)已知NH3,NF3,N(CH3)3都可以与铜离子生成配离子。
①稳定性[Cu(NH3)4]2+__________[Cu(NF3)4]2+。(填“低于”, “高于”,“不确定” )
②已知稳定性[Cu(NH3)4]2+高于[Cu[N(CH3)3]4]2+,请简要解释原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料知,NO可与炽热的铜粉发生反应,他们设计如下装置(夹持装置略去)进行实验验证。
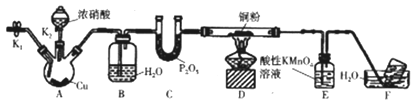
已知:NO能被酸性高锰酸钾溶液氧化生成NO3-。
请回答下列问题:
(1)实验开始前,检查装置气密性的方法是关闭K1、K2,将导管未端置于盛水的水槽中,______________,则表明装置气密性良好;装置A中发生反应的离子方程式为___________________。
(2)装置B的作用为____________________。
(3)装置A中反应开始前,需要先打开K1,向装置中通入一段时间的N2或CO2,其目的是______________________。
(4)实验过程中,装置D中铜粉变黑,装置E中溶液颜色变浅,则装置E中发生反应的离子方程式为_________________________。请设计一种简单的实验方案,证明该离子反应中的氧化产物为NO3-________________________(写出主要的操作过程、现象、结论)。
(5)从绿色化学角度考虑,实验结束后,拆卸装置前,还应进行的一项操作是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.实验用过的药品可以不经过处理直接丢弃
B.易分解实验药品应存放在无色玻璃瓶中
C.凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂.
D.实验室制备有毒有害气体需要在通风橱中进行,必须对尾气进行吸收或处理,防止中毒或污染大气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com