
【题目】某同学为验证元素周期表中元素性质的递变规律,设计了如下实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应的速率最慢;_____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明C1的非金属性比S强,反应的离子方程式为:_______________。
II.利用下图装置可验证同主族非金属性的变化规律。

(3)仪器B的名称为__________,干燥管D的作用为___________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液_____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液______的现象,即可证明。但有的同学认为盐酸具有挥发性,应用______溶液除去。
【答案】钾 铝 铝 S2-+Cl2=S↓+2C1- 锥形瓶 防止倒吸 变蓝 NaOH[或Ca(OH)2] 有白色沉淀生成 饱和NaHCO3
【解析】
I.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式;
II.(3)根据仪器的构造写出仪器B的名称;球形干燥管具有防止倒吸的作用;
(4)氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色;氯气有毒,氯气能够与氢氧化钠溶液反应;
(5)碳酸酸性强于硅酸,二氧化碳能够与硅酸钠反应生成白色沉淀硅酸;除去二氧化碳中氯化氢,可以使用饱和碳酸氢钠溶液。
I.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为S2﹣+Cl2=S↓+2Cl﹣;
Ⅱ.(3)仪器B为锥形瓶;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;
(4)KMnO4与浓盐酸常温下反应生成氯气,氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色,氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气;
(5)盐酸与碳酸钙反应生成CO2,CO2能与硅酸钠反应生成硅酸沉淀,则在A中加盐酸、B中加CaCO3、C中加NaSiO3溶液观察到C中溶液有白色沉淀生成的现象,即可证明非金属性C>Si。氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶。


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 写出该反应的离子方程式 .
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是 .
A.﹣1
B.+1
C.+3
D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式 .
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为kJ.
(5)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为: .
②上述反应中,正反应速率为υ正=k正x2(HI),逆反应速率为υ逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母).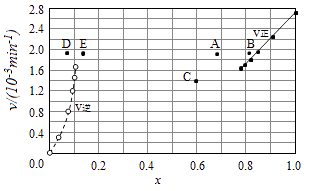
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
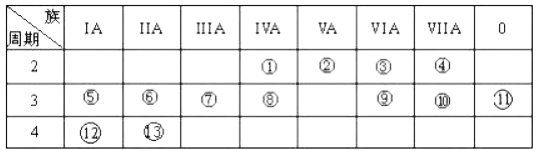
(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是( )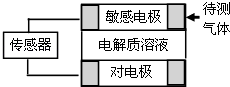
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2+2e﹣═2Cl﹣
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________,基态S原子的原子轨道数是____个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______,占据该能级的电子数为__________。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______。
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是_______(填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____个,这些配位键中提供孤电子对的元素是__________。
②S原子的杂化方式为_______、带*N原子的杂化方式为_______。
(5)下图是Cu-Au合金的一种立方晶体结构:

已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______cm(写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
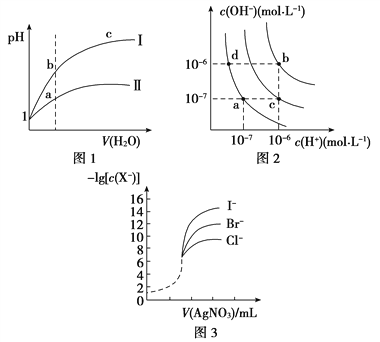
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、碱石灰B.铜、二氧化硫
C.液态的HCl、酒精D.KNO3溶液、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):
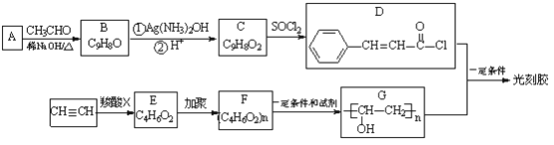
已知:
Ⅰ.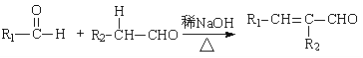 (R,R’为烃基或氢)
(R,R’为烃基或氢)
Ⅱ.![]() (R,R’为烃基)
(R,R’为烃基)
(1)写出A的结构简式__________。
(2)B分子中所含官能团的名称为__________。
(3)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E![]() F的化学方程式为____________。
F的化学方程式为____________。
(4)由F到G的反应类型为__________。
(5)D和G反应生成光刻胶的化学方程式为__________。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应
②苯环上的一氧取代产物只有两种。写出该同分异构体的结构简式:_________。
(7)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]() _______________________
_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com