
【题目】下表是元素周期表的一部分,回答下列有关问题:
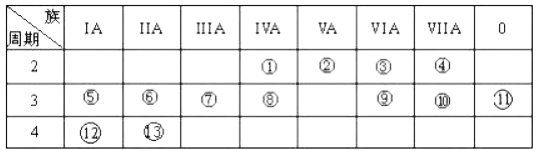
(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
【答案】 氮 氩 K Cl b Al(OH)3+3H+=Al3++3H2O 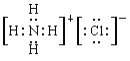
【解析】首先根据元素在周期表中的相对位置判断出元素名称,然后结合元素周期律以及相关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~分别是C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca。则
(1)根据以上分析可知②、的元素名称分别是氮、氩。
(2)同周期自左向右金属性逐渐减弱,同主族从上到下金属性逐渐增强,则在这些元素中,金属性最强的元素是K;同周期自左向右非金属性逐渐增强,则元素⑨与元素⑩相比,非金属性较强的是Cl。a.非金属性强弱与其单质的状态没有关系,a错误;b.非金属性越强,氢化物越稳定,则⑩的氢化物比⑨的氢化物稳定说明氯元素的非金属性强于硫元素,b正确;c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应不能说明二者的非金属性强弱,c错误。答案选b;
(3)⑦的最高价氧化物对应水化物氢氧化铝与⑩的最高价氧化物对应水化物高氯酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;
(4)②的气态氢化物氨气与HC1在空气中相遇有白烟生成,生成物是氯化铵,含有离子键的离子化合物,电子式为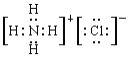 。
。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】已知CH3-CH=CH2+![]() →
→![]() +CH2=CH2下列说法不正确的是( )
+CH2=CH2下列说法不正确的是( )
A. 上述四种物质互为同系物
B. 上述反应的四种分子中,所有碳原子均可以共平面
C. 与![]() 结构相似,含有双键和苯环的同分异构体还有5种
结构相似,含有双键和苯环的同分异构体还有5种
D. CH3-CH=CH2 与溴的四氯化碳溶液反应时,只能生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
Ⅰ.实验步骤
(1)用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.
(4)滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近又发现了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( )
A. 离子晶体 B. 分子晶体 C. 原子晶体 D. 金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,设计了如下实验。
I.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应的速率最慢;_____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明C1的非金属性比S强,反应的离子方程式为:_______________。
II.利用下图装置可验证同主族非金属性的变化规律。

(3)仪器B的名称为__________,干燥管D的作用为___________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液_____的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液______的现象,即可证明。但有的同学认为盐酸具有挥发性,应用______溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅芯片是各种计算机、微电子产品的核心.工业上通过以下反应将自然界的二氧化硅转化为硅:SiO2+2C ![]() Si+2CO↑,下列针对该反应的分析不正确的是( )
Si+2CO↑,下列针对该反应的分析不正确的是( )
A.属于置换反应
B.碳发生了还原反应
C.二氧化硅是氧化剂
D.24g碳充分反应生成28g硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com