
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
Ⅰ.实验步骤
(1)用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为mL.
(4)滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
①按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.![]()
【答案】
(1)酸式滴定管,容量瓶
(2)酚酞
(3)0.60
(4)溶液由无色恰好变为红色,并在半分钟内不褪色
(5)0.75,4.5,ab
【解析】解:Ⅰ.(1)滴定管精确度为0.01ml,醋酸具有酸性能腐蚀橡胶管,所以应选用酸式滴定管量取白醋;用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液;
故答案为:酸式滴定管;容量瓶;
(2)由于醋酸钠溶液显示碱性,可用酚酞作指示剂,则用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞,
故答案为:酚酞;
(3)滴定管液面的读数0.60mL;
故答案为:0.60;
(4)NaOH滴定食醋的终点为:溶液由无色恰好变为红色,并在半分钟内不褪色;
故答案为:溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ.①第1次滴定误差明显大,属异常值,应舍去,3次消耗NaOH溶液的体积为:15.00mL、15.05mL、14.95mL,则NaOH溶液的平均体积为15.00mL;
设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~ | NaOH |
60 | 40 |
xg×0.2 | 0.1000mol/L×0.015L×40g/mol |
x=0.450
c(市售白醋)= ![]() =0.75molL﹣1,样品总酸量
=0.75molL﹣1,样品总酸量 ![]() =4.50g100mL﹣1;
=4.50g100mL﹣1;
故答案为:0.75;4.5;②a.碱式滴定管在滴定时未用标准NaOH溶液润洗,标准液浓度降低,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故a正确;
分析,可知c(待测)偏大,故a正确;
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)= ![]() 分析,可知c(待测)偏大,故b正确;
分析,可知c(待测)偏大,故b正确;
c.锥形瓶中加入待测白醋溶液后,再加少量水,对V(标准)无影响,根据c(待测)= ![]() 分析,可知c(待测)不变,故c错误;
分析,可知c(待测)不变,故c错误;
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出,待测液物质的量偏小,造成V(标准)偏小,根据c(待测)= ![]() 分析,可知c(待测)偏小,故d错误;
分析,可知c(待测)偏小,故d错误;
故选:ab.
Ⅰ.(1)量取10.00mL食用白醋,需要精确到0.01mL,结合醋酸的性质选择仪器;溶液的定容在对应体积的容量瓶中进行;
(2)醋酸钠呈碱性,可用酚酞作指示剂;
(3)根据滴定管的结构与精确度来判断读数;
(4)滴定终点时溶液由无色恰好变为红色,并在半分钟内不褪色;
Ⅱ.(1)根据数据的合理性求出平均消耗的NaOH溶液的体积,然后根据白醋与NaOH 溶液反应的关系式:CH3COOOH~NaOH来解答;
(2)根据![]() 分析不当操作对V(标准)的影响,以此判断浓度的误差.
分析不当操作对V(标准)的影响,以此判断浓度的误差.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】废弃物回收利用可变废为宝。某工业固体废物的组成为Al2O3、FeO、Fe2O3等。下图是以该固体废物为原料制取氧化铝、磁性Fe3O4胶体粒子的一种工艺流程:

(1)检验制备Fe3O4胶体粒子成功的实验操作名称是____________________________。
(2)写出由溶液B制备磁性Fe3O4胶体粒子的离子方程式__________________________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2。其原因是____________________________。
(4)向溶液C中加入NaHCO3溶液,溶液的pH_________(填“增大”,“不变”或“减小”)。
(5)固体D是Al(OH)3,空温时Al(OH)3溶于NaOH溶液反应的平衡常数等于20,则此时Al(OH)3![]() A1O2-+H++H2O的电离常数K=_______________。
A1O2-+H++H2O的电离常数K=_______________。
(6)用重路酸钾(K2Cr2O7)可测定产物磁性Fe3O4胶体粒子中铁元素的含量,过程如下图。已知,反应中K2Cr2O7被还原为Cr3+。

①写出甲→乙的化学方程式___________________________________。
②写出乙→丙的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 写出该反应的离子方程式 .
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是 .
A.﹣1
B.+1
C.+3
D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式 .
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为kJ.
(5)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为: .
②上述反应中,正反应速率为υ正=k正x2(HI),逆反应速率为υ逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母).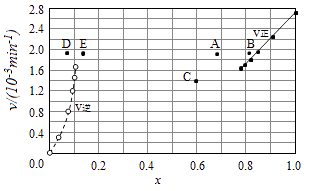
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色济液中,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,试回答下列问题:

(1)该溶液中一定不存在的阴离子有_______。
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为_______________________________。
(3)原得液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)实验所加的NaOH溶液的浓度为________。
(5)溶液中存在一种不能确定的阳离子,请设计实验方案加以检验_________________________。
(6)原溶液中NO3-的浓度为c(NO3-)则c(NO3-)的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子.X和Y所形成的稳定化合物的摩尔质量为( )
A.148gmol﹣1
B.100gmol﹣1
C.90gmol﹣1
D.38gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某种酶生物燃料电池的工作原理示意图。下列说法中不正确的是
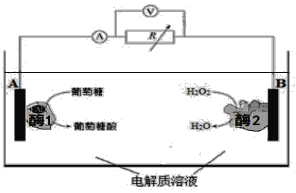
A. 葡萄糖是还原剂
B. 外电路中电子由A极移向B极
C. 溶液中H+ 由B极区移向A极区
D. B极电极反应式为:H2O2 +2H++2e-=== 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
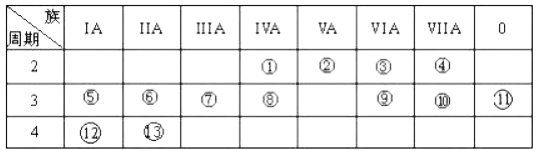
(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、碱石灰B.铜、二氧化硫
C.液态的HCl、酒精D.KNO3溶液、CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com