
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下.11.2L丙烷含有的极性键数目为5NA
B. 7g锂在空气中完全燃烧时转移的电子数为NA
C. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为6NA
D. 常温下,0.2L0.5mol/LNH4NO3溶液中含有的氮原子数小于0.2NA
科目:高中化学 来源: 题型:
【题目】某无色济液中,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,试回答下列问题:

(1)该溶液中一定不存在的阴离子有_______。
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为_______________________________。
(3)原得液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)实验所加的NaOH溶液的浓度为________。
(5)溶液中存在一种不能确定的阳离子,请设计实验方案加以检验_________________________。
(6)原溶液中NO3-的浓度为c(NO3-)则c(NO3-)的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
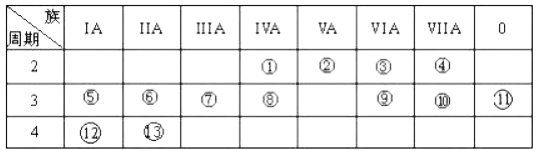
(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________,基态S原子的原子轨道数是____个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______,占据该能级的电子数为__________。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______。
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是_______(填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____个,这些配位键中提供孤电子对的元素是__________。
②S原子的杂化方式为_______、带*N原子的杂化方式为_______。
(5)下图是Cu-Au合金的一种立方晶体结构:

已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______cm(写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
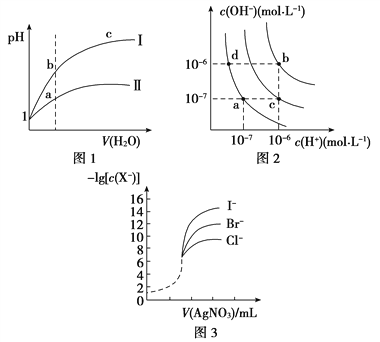
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 分子式为C3H8与C6H14的两种有机物一定互为同系物
B. 具有相同的分子式,不同结构的有机物一定是同分异构体
C. 两个相邻同系物的相对分子质量数值一定相差14
D. 具有相同的相对分子质量,不同结构的有机物一定是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、碱石灰B.铜、二氧化硫
C.液态的HCl、酒精D.KNO3溶液、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5 . 回答下列问题.
(1)已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5 , 放出热量123.8kJ.该反应的热化学方程式为 .
(2)反应AX3(g)+X2(g)AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①下列不能说明反应达到平衡状态的是 .
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1molAX3同时消耗1molAX5
②计算实验a从反应开始至达到平衡时的反应速率v(AX5)=(保留2位有效数字).
③图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c . 该反应在实验a和实验c中的化学平衡常数的大小关系是KaKc(填“>、<或=”),其中Kc=(保留小数点后1位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(Lmin),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )
A.x:y=3:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0.4mol/L
D.A与B的平衡浓度之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com