
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.
B.
C.
D.
【答案】A
【解析】
平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用。
A.盐酸是强酸,在溶液中完全电离,不存在电离平衡,故A选;
B.水是弱电解质,存在电离平衡H2OH++OH-,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;
C.存在平衡2NO2N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故C不选;
D.沸水中滴加饱和FeCl3溶液,温度升高促进Fe3+的水解生成氢氧化铁胶体,可以用平衡移动原理解释,故D不选;
故答案为A。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】氮氧化物NOx(主要指NO和NO2)会形成酸雨、光化学烟雾,破坏臭氧层,是大气主要污染物之一,有效去除大气中的NOx是环境保护的重要课题。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内υ(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后NO的转化率α1=____。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”)。
(2)NO能与N2O反应生成N2和NO2,反应的能量变化如下图所示,若生成1 mol N2,其ΔH=____kJ·mol-1。
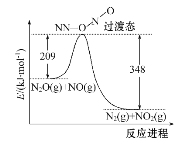
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。
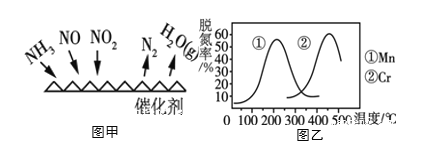
①由图甲可知,SCR技术中的氧化剂为_____________。当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为______________。
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂为________。
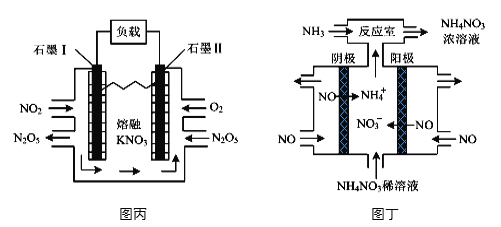
(4)利用电化学装置可消除氮氧化物污染,变废为宝。图丙装置实现的能量转化形式是_______。图丁为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水作氧化剂的是________。
A.Cl2+H2OHCl+HClO
B.NaH+H2O=NaOH+H2↑
C.3Fe+4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
D. H2+CuO![]() H2O+Cu
H2O+Cu
E. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请填写下列空白:
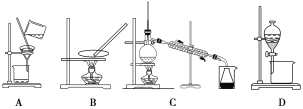
(1)步骤③和⑤的实验操作名称分别是________________、____________。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是________,该装置的操作名称为__________。
(3)步骤④反应的离子方程式是___________________________。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:

①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
(4)在一定温度下,有a、硫酸氢钠b、硫酸c、醋酸三种溶液,若三者c(H+)相同时,物质的量浓度由大到小的顺序是_____,当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.含0.1 molCl2的新制氯水中Cl-和ClO-粒子总数为0.2NA
B.pH=1的H2SO4中含有H+数目为0.1NA
C.NaH与水反应生产22.4L(标准状况)H2转移电子数为2NA
D.将0.1molNH4Cl溶于稀氨水中使溶液呈中性,溶液中NH4+数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.10mol/L的NaA溶被中,不断通入HCl气体(忽略溶液体积变化),得到c(A-)和c(HA)与pH的变化关系如下,则下列说法正确的是

A. 水的电离程度:X<Z
B. 溶液的pH比较:X<Y<Z
C. Y点时:c(Na+)=2c(A-)>c(H+)>c(OH-)
D. 常温下、HA的Ka=104.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离提纯(括号内的物质为杂质)的方法错误的是( )
A.乙醇(水)--加入CaO蒸馏
B.NaCl(KNO3)--结晶和重结晶
C.乙酸乙酯(乙醇、乙酸)--饱和碳酸钠溶液,分液
D.己烷(己烯)--溴水,分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com