
【题目】在下列反应中,水作氧化剂的是________。
A.Cl2+H2OHCl+HClO
B.NaH+H2O=NaOH+H2↑
C.3Fe+4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
D. H2+CuO![]() H2O+Cu
H2O+Cu
E. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【答案】BCE
【解析】
此题考查的是对于氧化还原反应基本概念的理解,抓住氧化还原的本质即电子得失与偏移,这一过程的直观表现就是元素化合价的变化,因此水中的氢元素如果发生了降价,就证明起到了氧化剂的作用。
A.水中的H元素未变价,发生变价的只有Cl元素,A项不符合;
B.![]() 中的H为-1价,反应后变成0价,起还原剂的作用;水中的H为+1价,反应后变成0价,起氧化剂的作用,B项符合;
中的H为-1价,反应后变成0价,起还原剂的作用;水中的H为+1价,反应后变成0价,起氧化剂的作用,B项符合;
C.反应前后,氢元素从+1价变成了0价,水起到了氧化剂的作用,C项符合;
D.反应前后,氢元素从0价变成了+1价,水是氧化产物不是氧化剂,D项不符合;
E.反应前后,氢元素从+1价变成了0价,水起到了氧化剂的作用,E项符合;
答案为BCE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2 mol A和4 mol B混合发生下列反应:
A(g)+2B(g) ![]() 2C(g) ΔH<0。
2C(g) ΔH<0。
(1)当反应达到平衡时,A和B的浓度比是_______;A和B的转化率比是_______。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_________,密度_________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度______(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: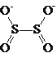 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)
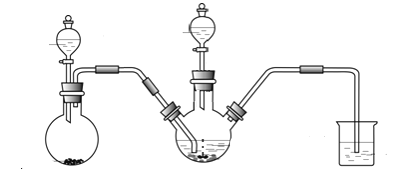
(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
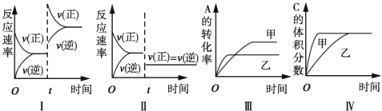
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是

A.含硫物种B表示HS-
B.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C.X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值
D.NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-===CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。在基态14C原子中,核外存在_______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是_______。
(3)CS2分子中,共价键的类型有___,C原子的杂化轨道类型是____,写出两个与CS2具有相同空间构型和键合形式的分子或离子___。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于__晶体,1mol Fe(CO)5有σ键__NA
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
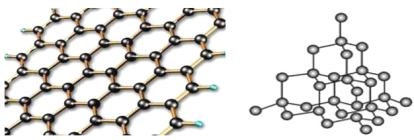
①在石墨烯晶体中,每个C原子连接___个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接__个六元环,六元环中最多有___个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)![]() xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)ΔH未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)

A.P3>P4,y轴表示C的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com