
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
【答案】D
【解析】
本题考查了氧化还原反应原理,还原剂判断,电极材料选取和工业流程图分析。
A. 由图可知,“反应1”是ZnFeO4与H2反应生成ZnFeO3.5,ZnFeO4化合价降低,发生还原反应,还原产物是ZnFeO3.5;“电解”是硫酸锰电解生成硫酸和二氧化锰,硫酸锰发生氧化反应,氧化产物是MnO2,A错误;
B. “反应2”中二氧化硫转化为硫单质,SO2发生还原反应,是氧化剂;“吸收”中SO2转化为硫酸根,发生氧化反应,是还原剂,B错误;
C. 金属作为循环II中电解过程中的阳极材料时,参与电解反应,故不能用铁丝,C错误;
D. 由于二氧化硫转化为硫单质或硫酸根,根据S守恒可知,n(S)=n(H2SO4),D正确。
答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①CH3OH(g)+O2(g)=CO (g)+2H2O(l) △H1;CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H2; △H1<△H2
②2H2O(l) =2H2(g)+O2(g) △H1; 2Na(s)+2H2O(l) =2NaOH(aq)+H2(g) ΔH2; △H1>△H2
③H2(g)+Cl2(g)=2HCl(g) △H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g) △H2; △H1>△H2
Cl2(g)=HCl (g) △H2; △H1>△H2
④t ℃时,在一定条件下,将 1 mol N2和 3 mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2 ; Q1<Q2
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式书写及对应表述均正确的是( )
A.已知2C(s)+O2(g)=2CO(g) △H=-22.1kJ·mol-1则可知C的燃烧热△H=-11.05kJ·mol-1
B.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s) =FeS(s) △H=-95.6kJ·mol-1
C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)=2H2(g) + O2(g) △H=+285.5kJ·mol-1
D.1L0.5mol/LH2SO4溶液与1L0.5mol/LBa(OH)2溶液完全反应生成1molH2O放出的热叫做中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
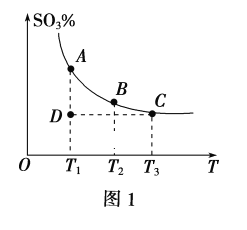
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正___(填“>”“<”或“=”)v逆。
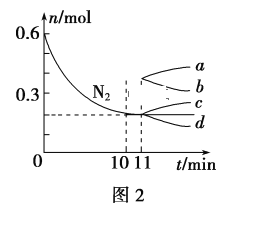
(2)已知N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
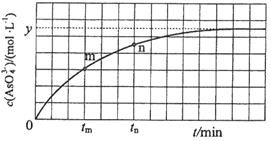
(3)298K时,将20mL3xmol·L-1 Na3AsO3、20mL3xmol·L-1I2和20 mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是___(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.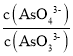 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③tm时v逆___tn时v逆(填“大于”“小于”或“等于”),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写正确的是( )
A.NaHCO3 =Na+ + H ++CO32-B.KHSO4 =K+ + H + + SO42-
C.H2SO3![]() 2H++ SO32-D.CHCOONH4
2H++ SO32-D.CHCOONH4 ![]() CHCOO - +NH4+
CHCOO - +NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3A(g)+B(g) = 2C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(C)=0.8 mol /(L·s)B.v(B)=0.3 mol/(L·s)
C.v(A)=0.5 mol /(L·s)D.v(D)=1 mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是
某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是![]()
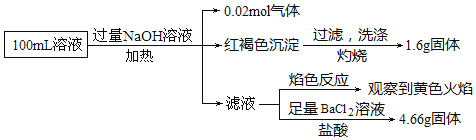
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 一定不存在
一定不存在
C.要确定原溶液中是否含有![]() ,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
A.向某无色溶液中加入![]() 溶液产生不溶于稀
溶液产生不溶于稀![]() 的白色沉淀,说明原溶液中一定有
的白色沉淀,说明原溶液中一定有![]()
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有![]()
C.利用碘在水中和有机溶剂中溶解度的差异,向碘水中加入![]() 萃取碘
萃取碘
D.从实验室加热氯酸钾与![]() 的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com