
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是
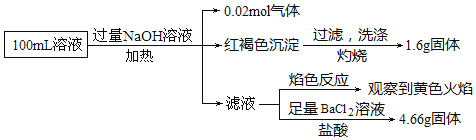
某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是![]()
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 一定不存在
一定不存在
C.要确定原溶液中是否含有![]() ,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
【答案】D
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;颜色反应为黄色,则溶液中存在钠离子,由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子;根据溶液电中性判断是否存在氯离子,以此解答该题。
![]() 根据以上分析可知,原溶液中含有
根据以上分析可知,原溶液中含有![]() 铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
B. 根据以上分析可知,原溶液中一定存在![]() 、
、![]() 、
、![]() ,只是存在
,只是存在![]() 、
、![]() 中的一种,其离子的物质的量为
中的一种,其离子的物质的量为![]() ,一定不存在
,一定不存在![]() ;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
C. 检验亚铁离子时,取少量原溶液于试管中,加KSCN溶液,此时溶液现象必须是无色,然后再加入适量氯水,溶液呈血红色,则含有![]() ,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故C错误;
,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故C错误;
D. 根据以上分析,原溶液中一定存在![]() ,
,![]() ,
,![]() 、
、![]() 中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:
中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:![]() ,而负电荷的物质的量为:
,而负电荷的物质的量为:![]() ,根据溶液电中性可知,原溶液中一定存在
,根据溶液电中性可知,原溶液中一定存在![]() ,且
,且![]() ,故D正确;
,故D正确;
故答案选D。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法中不正确的是 ( )
A. “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致.
B. 加入Na2S可消除污水中Hg2+ 的污染。
C. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目
D. 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH![]()
![]() ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为:
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 溶液中,
溶液中,![]()
B.室温时水电离出来的![]() 的溶液中
的溶液中![]() 、
、![]() 、
、![]() 、
、![]() 一定能大量共存
一定能大量共存
C.等物质的量浓度的下列溶液:①![]() ②
②![]() ③
③![]() ④
④![]() 中
中![]() 的大小关系为:②>④>③>①
的大小关系为:②>④>③>①
D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液只含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是
中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是![]()
![]()

A.一定含有![]() 、
、![]() 、
、![]() 、
、![]() ;一定不含
;一定不含![]() 、
、![]() 、
、![]() 、
、![]()
B.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]()
C.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]() 、
、![]()
D.一定含有![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论均正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有 |
C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
D | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com