
【题目】X溶液只含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是
中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是![]()
![]()

A.一定含有![]() 、
、![]() 、
、![]() 、
、![]() ;一定不含
;一定不含![]() 、
、![]() 、
、![]() 、
、![]()
B.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]()
C.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]() 、
、![]()
D.一定含有![]() 、
、![]() 、
、![]() 、
、![]()
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:

(1)步骤①加Fe的目的是__;步骤②冷却的目的是__。
(2)上述制备TiO2的过程中,可以利用的副产物是__;考虑成本和废物综合利用因素,废液中应加入___处理。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
![]() →
→![]()
![]()
![]()
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3A(g)+B(g) = 2C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(C)=0.8 mol /(L·s)B.v(B)=0.3 mol/(L·s)
C.v(A)=0.5 mol /(L·s)D.v(D)=1 mol /(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应先后顺序判断正确的是![]()
A.向含有等物质的量的![]() 、KOH的混合溶液中通入
、KOH的混合溶液中通入![]() ,与
,与![]() 反应的物质依次是:KOH、
反应的物质依次是:KOH、 ![]() 、
、![]()
B.向含有等物质的量的![]() 、
、![]() 、
、![]() 的混合溶液中加入Zn,与Zn反应的离子依次是:
的混合溶液中加入Zn,与Zn反应的离子依次是:![]() 、
、![]() 、
、![]()
C.向含有等物质的量的![]() 、
、![]() 、
、![]() 的混合溶液中滴加盐酸,与盐酸反应的物质依次是:
的混合溶液中滴加盐酸,与盐酸反应的物质依次是:![]() 、
、![]() 、
、![]() 、
、![]()
D.在含有等物质的量的![]() 、
、![]() 的溶液中,缓慢通入氯气,与氯气反应的离子依次是:
的溶液中,缓慢通入氯气,与氯气反应的离子依次是:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是
某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是![]()
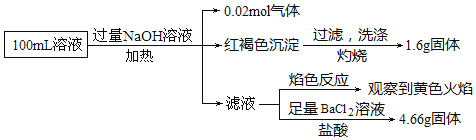
A.原溶液中![]()
B.![]() 、
、![]() 、
、![]() 一定存在,
一定存在,![]() 一定不存在
一定不存在
C.要确定原溶液中是否含有![]() ,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有
,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有![]()
D.溶液中至少有4种离子存在,其中![]() 一定存在,且
一定存在,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空。
Ⅰ.常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+和OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:
________________________________________________________________________。
(2)实验测得NaHA溶液的pH>7,请分析NaHA溶液显碱性的原因:
________________________________________________________________________。
请写出NaHA溶液中离子浓度由大到小的顺序:
________________________________________________________________________。
Ⅱ.(1)如图甲表示用相同浓度的NaOH溶液分别滴定浓度相同的三种一元酸,由图可确定酸性最强的是________(填“①”“②”或“③”)。如图乙表示用相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是________。

(2)25 ℃时,Ksp(AgCl)=1.8×10-10。在1 L 0.1 mol·L-1 NaCl溶液中加入1 L 0.2 mol·L-1AgNO3溶液,充分反应后溶液中c(Cl-)=________ mol·L-1(假设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
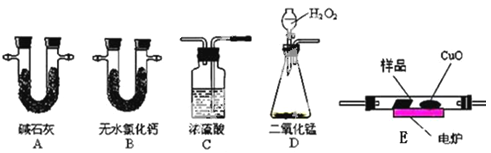
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,方案Ⅰ和方案Ⅱ均可行,且方案Ⅱ更合理的是
实验目的 | 方案Ⅰ | 方案Ⅱ | |
A | 除去乙酸乙酯中的少量乙酸 | 加饱和 | 蒸馏 |
B | 鉴别碳酸钠和碳酸氢钠溶液 | 分别滴加澄清石灰水 | 分别加热两溶液 |
C | 检验亚硫酸钠是否被氧化 | 滴入 | 滴入盐酸酸化的 |
D | 比较氯元素、碘元素的非金属性强弱 | 分别加热氯化氢、碘化氢,比较热稳定性 | 在淀粉碘化钾试纸上滴加氯水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。

方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com