
【题目】下列实验中,方案Ⅰ和方案Ⅱ均可行,且方案Ⅱ更合理的是
实验目的 | 方案Ⅰ | 方案Ⅱ | |
A | 除去乙酸乙酯中的少量乙酸 | 加饱和 | 蒸馏 |
B | 鉴别碳酸钠和碳酸氢钠溶液 | 分别滴加澄清石灰水 | 分别加热两溶液 |
C | 检验亚硫酸钠是否被氧化 | 滴入 | 滴入盐酸酸化的 |
D | 比较氯元素、碘元素的非金属性强弱 | 分别加热氯化氢、碘化氢,比较热稳定性 | 在淀粉碘化钾试纸上滴加氯水 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】如图是反应CO(g) +2H2(g) ![]() CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )

A.加入催化剂,该反应的△H变小
B.如果该反应生成液态CH3OH,则△H变大
C.该反应的△H=+91 kJ/moL
D.反应物的总能量大于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液只含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是
中的几种,现进行如下实验:根据上述实验,对X溶液的判断正确的是![]()
![]()

A.一定含有![]() 、
、![]() 、
、![]() 、
、![]() ;一定不含
;一定不含![]() 、
、![]() 、
、![]() 、
、![]()
B.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]()
C.一定含有![]() 、
、![]() 、
、![]() ;可能含有
;可能含有![]() 、
、![]()
D.一定含有![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备四水甲酸铜[Cu(HCOO)24H2O]晶体实验步骤如下。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是______。
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到_____(写实验现象),说明温度过高。
c.相关的化学方程式______。
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式______。
b.趁热过滤中,必须趁热的原因是______。
c.用乙醇洗涤晶体的目的______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论均正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有 |
C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
D | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟用定量的方法测量Al与酸反应的快慢。
(1)实验测得铝丝产生气体的速率(v)与时间(t)的关系如下图所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________;t2~t3时间段内反应速率逐渐减慢的主要原因是___________________________________
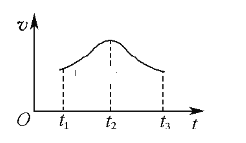
(2)某同学取等体积、等浓度的 a 稀硫酸、b 盐酸、c 醋酸 三种酸溶液分别加入足量的铝粉进行如上实验,开始时三种溶液中反应速率由快到慢的顺序是_________________;反应完毕产生气体体积的由大到小顺序是_________________(相同条件)。(以上两空用序号排序回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )

A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:
①准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;
② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;
③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。
次硫酸氢钠甲醛和碘反应的方程式如下:xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com