
【题目】下列实验能达到预期目的是
A.向某无色溶液中加入![]() 溶液产生不溶于稀
溶液产生不溶于稀![]() 的白色沉淀,说明原溶液中一定有
的白色沉淀,说明原溶液中一定有![]()
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有![]()
C.利用碘在水中和有机溶剂中溶解度的差异,向碘水中加入![]() 萃取碘
萃取碘
D.从实验室加热氯酸钾与![]() 的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
【答案】C
【解析】
![]() 某溶液中滴加
某溶液中滴加![]() 溶液,生成不溶于稀
溶液,生成不溶于稀![]() 的白色沉淀,该溶液中一定含有氯离子或是硫酸根离子中的至少一种,故A错误;
的白色沉淀,该溶液中一定含有氯离子或是硫酸根离子中的至少一种,故A错误;
B.某溶液中加入稀盐酸产生无色无味的气体,应为二氧化碳,该溶液中可能为![]() 或
或![]() ,故B错误;
,故B错误;
C.利用碘在水中和有机溶剂中溶解度的差异较大,水和四氯化碳互不相溶,可用四氯化碳萃取碘水中碘,故C正确;
D.反应后的剩余固体中,一定含有二氧化锰和氯化钾,可能含有氯酸钾;先加入足量的水,氯化钾溶于水形成溶液,如果含有氯酸钾时,氯酸钾溶于水形成溶液,而二氧化锰不溶于水;再过滤,把二氧化锰从溶液中分离出来;再对二氧化锰进行洗涤,除去二氧化锰中的杂质;再干燥二氧化锰,得到纯净的二氧化锰,故D错误;
故选:C。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论均正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有 |
C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
D | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟用定量的方法测量Al与酸反应的快慢。
(1)实验测得铝丝产生气体的速率(v)与时间(t)的关系如下图所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________;t2~t3时间段内反应速率逐渐减慢的主要原因是___________________________________
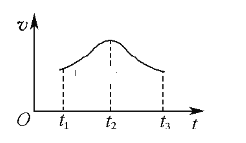
(2)某同学取等体积、等浓度的 a 稀硫酸、b 盐酸、c 醋酸 三种酸溶液分别加入足量的铝粉进行如上实验,开始时三种溶液中反应速率由快到慢的顺序是_________________;反应完毕产生气体体积的由大到小顺序是_________________(相同条件)。(以上两空用序号排序回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
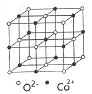
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com