
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写正确的是( )
A.NaHCO3 =Na+ + H ++CO32-B.KHSO4 =K+ + H + + SO42-
C.H2SO3![]() 2H++ SO32-D.CHCOONH4
2H++ SO32-D.CHCOONH4 ![]() CHCOO - +NH4+
CHCOO - +NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH ![]() Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH![]() 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是________。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________。
(5)上述装置中还需补充的实验仪器或装置有________![]() 填字母
填字母![]() 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mgL-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________。
(7)处理后的废水中氰化钠的浓度为_______ mgL-1;处理后的废水是否达到排放标准?_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.c(H+)=![]() 的溶液一定呈中性
的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
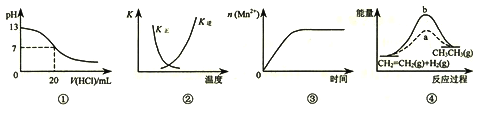
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的是
A.向某无色溶液中加入![]() 溶液产生不溶于稀
溶液产生不溶于稀![]() 的白色沉淀,说明原溶液中一定有
的白色沉淀,说明原溶液中一定有![]()
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有![]()
C.利用碘在水中和有机溶剂中溶解度的差异,向碘水中加入![]() 萃取碘
萃取碘
D.从实验室加热氯酸钾与![]() 的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
的混合物制氧气后的剩余物中回收二氧化锰的操作顺序是溶解、蒸发、洗涤、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
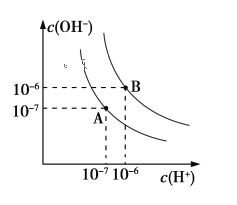
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
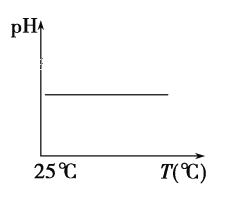
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有![]() 、
、![]() 、Si
、Si![]() 、Br-、C
、Br-、C![]() 、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有![]() 、Na+
、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④B.②③④
C.①③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
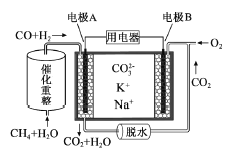
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com