
【题目】下列各表述与示意图一致的是
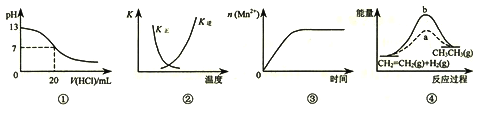
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c(Clˉ)为4.00 mol·L-1,c(Al3+)为1.00 mol·L-1
D.c (Mg2+)为1.00 mol·L-1,c(Na+ )为0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH3COOH、HF均为弱酸,酸性强弱顺序为CH3COOH <HF,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
D.NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
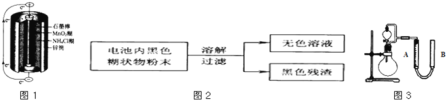
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某气体能使品红溶液褪色,则该气体是![]()
B.等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2;
Cu(NO3)2;
C.向某溶液中加入![]() 溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有
溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有![]()
D.向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:_____。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为_____;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为_____mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com