
����Ŀ���������洦����Ƥ�����ơ�ӡȾ�ȶ�������ɸ���Ⱦ�����۸������۸����Ըߣ����ױ����������������������
����ҵ�ϴ������Ժ�Cr2O72����ˮ�ķ������£�
����Cr2O72�������Է�ˮ�м���FeSO4��Һ��ʹCr2O72��ȫ��ת��ΪCr3����д���÷�Ӧ�����ӷ���ʽ��_____��
��������Һ��pH��ʹCr3����ȫ������ʵ���Ҵ��Բⶨ��ҺpH�ķ���Ϊ_____��25������������Һ��pH=8������Һ�в���Cr3�������ʵ���Ũ��Ϊ_____mol/L������֪25��ʱ��Ksp[Cr(OH)3]=6.3��10��31��
����Ԫ����Ũ�ȵIJⶨ��ȷ��ȡ25.00mL��Cr2O72����Cr3�������Է�ˮ�������м���������(NH4)2S2O8��Һ��Cr3��������Cr2O72������г�ȥ������(NH4)2S2O8����������Һ�м��������KI��Һ����ַ�Ӧ���Ե���Ϊָʾ���������еμ�0.015mol/L��Na2S2O3����Һ���յ�ʱ����Na2S2O3��Һ20.00mL��
��֪�ⶨ�����з����ķ�Ӧ���£�
��2Cr3����3S2O82����7H2O =Cr2O72����6SO42����14H��
��Cr2O72����6I����14H��=2Cr3����3I2��7H2O
��I2��2S2O32��=2I����S4O62��
�����ˮ�и�Ԫ����Ũ�ȣ���λ��mg��L��1��д��������̣���_____________________
���𰸡�Cr2O72����6Fe2����14H��=2Cr3����6Fe3����7H2O ��pH��ֽ���ڽྻ�ı������ϣ��ò�����պȡ��Һ�� ����pH��ֽ�ϣ��������ɫ������ 6.3��10��13 �ɷ���ʽ��֪��Cr~3Na2S2O3��֪��n(Na2S2O3)=20.00mL��0.015mol/L=3��10��4mol
n(Cr)=1��10��4mol��m(Cr)=1��10��4mol��52g��mol��1=5.2��10��3 g=5.2mg����ˮ�и�Ԫ����Ũ��=![]() =208 mg��L��1��
=208 mg��L��1��
��������
��1����Cr2O72����Fe2��֮�������Ի����·���������ԭ��Ӧ��
������ʹ��pH��ֽ������Һ����Է������з�����
ʵ���Ҵ��Բⶨ��ҺpH�ķ�����ʹ��pH��ֽ����pH��ֽ���ڽྻ�ı������ϣ��ò�����պȡ��Һ������pH��ֽ�ϣ��������ɫ�����գ�����c��Cr3����= 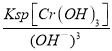 ���м��㣻
���м��㣻
��2���ɷ���ʽȷ����ϵʽ��Cr~3Na2S2O3��֪��n(Cr)= ![]() n(Na2S2O3)�����������m(Cr) mg����ˮ�и�Ԫ����Ũ��=
n(Na2S2O3)�����������m(Cr) mg����ˮ�и�Ԫ����Ũ��= ![]() ��
��
��1��������������ԭ��Ӧ���������ӱ�����Ϊ�����ӣ�Cr2O72����6Fe2����14H��=2Cr3����6Fe3����7H2O��
��ʵ���Ҵ��Բⶨ��ҺpH�ķ�����ʹ��pH��ֽ����pH��ֽ���ڽྻ�ı������ϣ��ò�����պȡ��Һ������pH��ֽ�ϣ��������ɫ�����գ�����Һ�в���Cr3�������ʵ���Ũ��Ϊ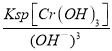 =
=![]() =6.3��10��13��
=6.3��10��13��
��2���ɷ���ʽȷ����ϵʽ��Cr~3Na2S2O3��֪��n(Na2S2O3)=20.00mL��0.015mol/L=3��10��4mol��n(Cr)=1��10��4mol��m(Cr)=1��10��4mol��52g��mol��1=5.2��10��3 g=5.2mg����ˮ�и�Ԫ����Ũ��=![]() =208 mg��L��1��
=208 mg��L��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ���
A. ͼ�ٱ�ʾ25��ʱ����0.1 mol��L��1����ζ�20 mL 0.1 mol��L��1NaOH��Һ����Һ��pH�����������ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)![]() 2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL 0.01 mol��L��1KMnO4������Һ�������0.1 mol��L��1H2C2O4��Һ���ʱ��n(Mn2+) ��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g) + H2(g)![]() CH3CH3(g)����H< 0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g)����H< 0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�ȼ�ϵ������Я�������״洢���ŵ㣬Ŀǰ����Ϊ���������ͳ�ĵ�س�ΪЯ�����豸����Ҫ��Դ����ͼ�Ǽ״������ӽ���Ĥ��ȼ�ϵ��ģ�ͣ������й�˵����ȷ����(����)
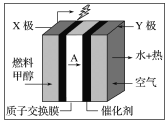
A.Y��Ϊ��صĸ���
B.X���ĵ缫��Ӧʽ��CH3OH��H2O��6e��=CO2��6H��
C.���������øõ�ص��100 mL KCl��Һ��pH��12ʱ��������ӽ���ĤǨ�Ƶ�AΪ0.01 mol
D.������20%Ϊ�������㣬X��ÿ����1 mol�״���Y��������168 L�����е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ú������ʣ�FeO��Fe2O3���ķ�CuO�Ʊ��������壬���������й��̣���֪ Fe3+�� ph=5ʱ������ȫ�������з����������
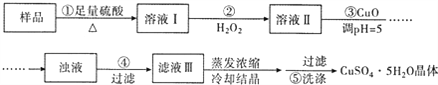
A. ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O
B. ����ڿ�����ˮ�������ǿ����������H2O2
C. ������� CuCO3����CuOҲ�ɵ�����Һ��pH
D. ����� �IJ���Ϊ����©���м��������������ˮ����û���壬��ˮ��Ȼ���£��ظ����� 2��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�U�ι���Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ��ʳ��ˮ�ʹ�����Һ�������������飬����һ��ʱ�䡣�����й���������ȷ����
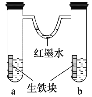
A.�������е�̼��ԭ��ص�����
B.��īˮˮ�����ߵ�Һ���Ϊ����Ҹ�
C.���Թ�����ͬ�ĵ缫��Ӧʽ��Fe-2e- = Fe2��
D.a�Թ��з�����������ʴ��b�Թ��з��������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ���ǣ� ��
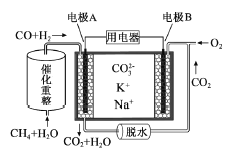
A. ��ӦCH4��H2O![]() 3H2��CO,ÿ����1molCH4ת��12mol ����
3H2��CO,ÿ����1molCH4ת��12mol ����
B. �缫A��H2����ĵ缫��ӦΪ��H2��2OH����2e��=2H2O
C. ��ع���ʱ��CO32����缫B�ƶ�
D. �缫B�Ϸ����ĵ缫��ӦΪ��O2��2CO2��4e��=2CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X��Y��Zת����ϵ��ͼ��ʾ�������ж���ȷ����(����)
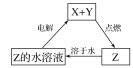
A. X�����ǽ���ͭ B. Y������������
C. Z�������Ȼ��� D. Z��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.NA���������ӵ�������1mol C4H10�к����ۼ���ĿΪ14NA
B.ij��Ӧ����H = ��88kJmol-1��������Ӧ���һ��С��88kJmol-1
C.��֪ij�¶��£�Kw = 1��10-13������pH =8��NaOH��Һ��pH =5��H2SO4��Һ��ϱ����¶Ȳ��䣬��ʹ�����ҺpH =7����NaOH��Һ��H2SO4��Һ�������Ϊ11��9
D.��Ũ��Ϊ0.1molL-1 HF��Һ��ˮ����ϡ�����У�����Ⱥ�Ka(HF)���ֲ��䣬![]() ʼ�ձ�������
ʼ�ձ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ��������������Ķ���������Ԫ�أ�Y��Zͬ���������ڣ�X��Wͬ��������Y���ڲ�ͬ���ڣ�Y��Zԭ�ӵĵ������ܺ���X��Wԭ�ӵĵ������ܺ�֮��Ϊ5��4��������WYZ2��һ�ֹ�ҵ�Σ�������Σ���ܴ�����������ȷ����
A.���⻯��ķе㣺Y<Z
B.������WY3��ֻ�������Ӽ�
C.ԭ�Ӱ뾶��W>Z>Y>X
D.X2Z��W2Z2�����ķ�Ӧ�У�X2Z������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com