
����Ŀ��ij��Һ�п��ܺ�������5�������е�ij���֣�Na+��NH4+��Mg2+��Al3+��Cl����Ϊȷ�ϸ���Һ��ɽ�������ʵ�飺��ȡ20.0 mL����Һ������25.0 mL 4.00 mol��L-1NaOH��Һ���а�ɫ���������ݼ���ζ���塣���ˡ�ϴ�ӡ�����ó���1.16 g���ٽ���Һϡ����100 mL�������Һ��c(OH��)Ϊ0.20 mol��L-1������ȡ20.0 mL����Һ������������AgNO3��Һ�����ɰ�ɫ����11.48 g���ɴ˿ɵó�����ԭ��Һ��ɵ���ȷ������
A.һ������Mg2+��Al3+��Cl��������Na+��NH4+
B.һ������Na+��Mg2+��Cl��������NH4+�����ܺ���Al3+
C.c(Cl��)Ϊ4.00 mol��L-1��c(Al3+)Ϊ1.00 mol��L-1
D.c (Mg2+)Ϊ1.00 mol��L-1��c(Na+ )Ϊ0.50 mol��L-1
���𰸡�D
��������
��25.0mL 4.00molL-1NaOH��Һ������0.1mol�������ƣ�����1.16gΪ������þ�����ʵ�����0.02mol�����ɳ�������0.04mol�������ƣ���Һ�е�n(OH-)=0.2molL-1��0.1L=0.02mol���ʻ���0.04mol�������ƺ�0.01molAl3+��Ӧ������ƫ�����ƣ���һ������Mg2+��Al3+���̼���ζ�������ɣ�һ��û��NH4+���ڰ�ɫ����11.48g���Ȼ��������ʵ����ǣ�![]() =0.08mol����һ�����������ӣ����ݵ���غ㣬������У�(0.02mol��2+0.01mol��3)=0.07mol��������У�0.08mol����һ������������0.01mol��
=0.08mol����һ�����������ӣ����ݵ���غ㣬������У�(0.02mol��2+0.01mol��3)=0.07mol��������У�0.08mol����һ������������0.01mol��
A���������Ϸ�����֪����Һ��һ�����ڣ�Na+��Mg2+��Al3+��Cl-����A����
B����Һ��һ�����ڣ�Na+��Mg2+��Al3+��Cl-����B����
C��c(Al3+)=![]() =0.5 molL-1��c(Cl-)=
=0.5 molL-1��c(Cl-)=![]() =4mol/L����C����
=4mol/L����C����
D��c(Mg2+)=![]() =1.00 molL-1��c(Na+)=
=1.00 molL-1��c(Na+)=![]() =0.50 molL-1����D��ȷ��
=0.50 molL-1����D��ȷ��
��ѡD��
�����硿
ע�����ճ������ӵ����ʼ����鷽�������ݵ���غ��ж������ӵĴ���Ϊ�����״��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.��״���£�1LC2H5OH��ȫȼ�պ����ɵ�CO2���Ӹ���ԼΪ![]()
B.20gD2O��20gH218O���е���������Ϊ10NA
C.1mol��L-1Al(NO3)3��Һ�к���3NA��NO3-
D.50mL12mol��L-1����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ��Ӻ�ˮ���Ʊ�NaOH��Һ����������ͼ��ʾ�������й�˵����ȷ����
![]()
A.����һ�õ������������������żܺ�������
B.���������NaOH��Ŀ���dz�ȥ![]()
C.������Ĺ��˲������ڼ�������֮��
D.���������һ����ӦΪ![]()
![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����SO32-��SiO32-��CO32-��Br-��Na+����Һ�л���ͨ��Cl2ֱ�����������жԸ÷�Ӧ���̵��ж���ȷ����![]()
A.�������̹�����2��������ԭ��Ӧ
B.�ڸ���Һ�е�����Ʒ�죬Ʒ����ɫ
C.�������ӵ�Ũ�ȶ������˱仯
D.��Ӧ��������������������������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O3Ҳ��һ�ֺܺõ������������и�Ч���ྻ�����㡢���õ��ŵ㡣O3������ˮ����ˮ���ֽ⣬������[O]Ϊ������ԭ�ӣ��к�ǿ��ɱ���������������³�ѹ�·�����Ӧ���£�
��Ӧ����O3![]() O2��[O] ��H��0 ƽ�ⳣ��ΪK1��
O2��[O] ��H��0 ƽ�ⳣ��ΪK1��
��Ӧ���� [O]��O3![]() 2O2 ��H��0 ƽ�ⳣ��ΪK2��
2O2 ��H��0 ƽ�ⳣ��ΪK2��
�ܷ�Ӧ�� 2O3![]() 3O2 ��H��0 ƽ�ⳣ��ΪK��
3O2 ��H��0 ƽ�ⳣ��ΪK��
����������ȷ����( )
A. �����¶ȣ�K��С B. K��K1��K2
C. �ʵ����£����������Ч�� D. ѹǿ����K2��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��Һ�еĵ��뷽��ʽ��д��ȷ���ǣ� ��
A.NaHCO3 ��Na+ + H ++CO32-B.KHSO4 ��K+ + H + + SO42-
C.H2SO3![]() 2H++ SO32-D.CHCOONH4
2H++ SO32-D.CHCOONH4 ![]() CHCOO - +NH4+
CHCOO - +NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.�����ʵ������������������ֱ���ȫȼ�գ����߷ų�������
B.��C(ʯī��s)=C(���ʯ��s) ��H=+1.9kJ/mol��֪�����ʯ��ʯī�ȶ�
C.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��285.8kJ/mol
D.��ϡ��Һ�У�H+(aq)+OH��(aq)=H2O(l) ��H=��57.3kJ/mol��������0.5molH2SO4��Ũ�����뺬1molKOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܴ���Br����CO![]() ��SO
��SO![]() ��Al3����I����Mg2����Na��7�������еļ��֣���ȡ����Һ����ʵ�飬�õ���������������Һ�еμ�������ˮ����Һ���ɫ��������ɫ����ð�����������ó�ɫ��Һ�м�������BaCl2��Һ���������ɣ�����������Һ�м����μӵ�����Һ����Һ������ɫ���ݴ˿����ƶϣ�����Һ�п϶������ڵ������� ( )
��Al3����I����Mg2����Na��7�������еļ��֣���ȡ����Һ����ʵ�飬�õ���������������Һ�еμ�������ˮ����Һ���ɫ��������ɫ����ð�����������ó�ɫ��Һ�м�������BaCl2��Һ���������ɣ�����������Һ�м����μӵ�����Һ����Һ������ɫ���ݴ˿����ƶϣ�����Һ�п϶������ڵ������� ( )
A.Al3����Na����S![]() ��I��B.Mg2����Na����CO
��I��B.Mg2����Na����CO![]() ��Br��
��Br��
C.Al3����Mg2����I����SO![]() D.Al3����CO
D.Al3����CO![]() ��Br����SO
��Br����SO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ���
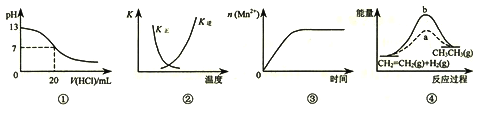
A. ͼ�ٱ�ʾ25��ʱ����0.1 mol��L��1����ζ�20 mL 0.1 mol��L��1NaOH��Һ����Һ��pH�����������ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)![]() 2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL 0.01 mol��L��1KMnO4������Һ�������0.1 mol��L��1H2C2O4��Һ���ʱ��n(Mn2+) ��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g) + H2(g)![]() CH3CH3(g)����H< 0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g)����H< 0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com