
【题目】向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断正确的是![]()
A.整个过程共发生2个氧化还原反应
B.在该溶液中滴少量品红,品红褪色
C.所有离子的浓度都发生了变化
D.反应过程中氯气既作氧化剂又作还原剂
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
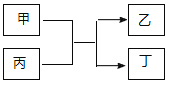
A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
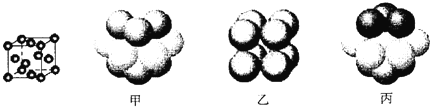
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )

A.a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
B.放电时,电子从a极经过负载流向b极
C.该电池持续放电时,离子交换膜需选用阴离子交换膜
D.电路中转移电子3NA时消耗氧气16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下向不同电解质溶液中加入新物质时,溶液导电性会发生变化。下列图示中,电流强度(I)随新物质加入量(m)的变化趋势与实验过程相符合的是

A. 向CH3COOH溶液中逐渐通入NH3至过量
B. 向NH4Cl溶液中逐渐加入NaOH固体至过量
C. 向Ba(OH)2溶液中滴入等浓度的硫酸至过量
D. 向NaAlO2溶液中滴入等浓度的盐酸至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaHCO3溶液的说法正确的是( )
A.该溶液中,H+、Al3+、Cl-能大量共存
B.溶液中c(H2CO3)<c(CO32-)
C.该溶液中阳离子总数大于阴离子总数
D.常温下,加水稀释,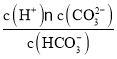 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入25.0 mL 4.00 mol·L-1NaOH溶液,有白色沉淀、无剌激气味气体。过滤、洗涤、干燥,得沉淀1.16 g。再将滤液稀释至100 mL,测得滤液中c(OHˉ)为0.20 mol·L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48 g。由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c(Clˉ)为4.00 mol·L-1,c(Al3+)为1.00 mol·L-1
D.c (Mg2+)为1.00 mol·L-1,c(Na+ )为0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线, 由曲线分析下列判断正确的是( )
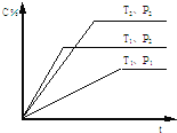
A.T1<T2,P1>P2,m+n>p,正反应吸热
B.T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D.T1>T2,P1<P2,m+n<p,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
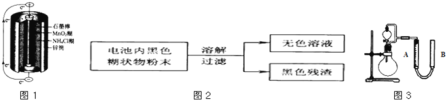
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com