
【题目】已知:可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线, 由曲线分析下列判断正确的是( )
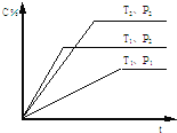
A.T1<T2,P1>P2,m+n>p,正反应吸热
B.T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D.T1>T2,P1<P2,m+n<p,正反应吸热
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图: ______ ;F基态原子的外围电子排布式: ______ .
⑵下列说法错误的是 ______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为 ______ ![]() 用元素符号表示
用元素符号表示![]() .
.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有 ______ .
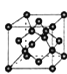
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 ______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm,F离子的半径bpm,求该晶胞的空间利用率 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断正确的是![]()
A.整个过程共发生2个氧化还原反应
B.在该溶液中滴少量品红,品红褪色
C.所有离子的浓度都发生了变化
D.反应过程中氯气既作氧化剂又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写正确的是( )
A.NaHCO3 =Na+ + H ++CO32-B.KHSO4 =K+ + H + + SO42-
C.H2SO3![]() 2H++ SO32-D.CHCOONH4
2H++ SO32-D.CHCOONH4 ![]() CHCOO - +NH4+
CHCOO - +NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及对应解释或结论正确的是![]()
选项 | 实验操作 | 解释或结论 |
A | 向某溶液中滴加盐酸酸化的 | 原溶液中一定含有 |
B | 将 |
|
C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是 ( )
、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是 ( )
A.Al3+、Na+、S![]() 、I-B.Mg2+、Na+、CO
、I-B.Mg2+、Na+、CO![]() 、Br-
、Br-
C.Al3+、Mg2+、I-、SO![]() D.Al3+、CO
D.Al3+、CO![]() 、Br-、SO
、Br-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH ![]() Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH![]() 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是________。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________。
(5)上述装置中还需补充的实验仪器或装置有________![]() 填字母
填字母![]() 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mgL-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________。
(7)处理后的废水中氰化钠的浓度为_______ mgL-1;处理后的废水是否达到排放标准?_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
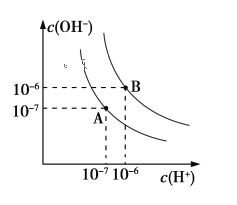
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
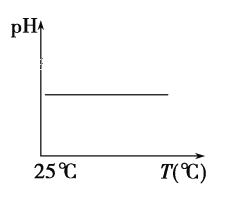
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com