
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH ![]() Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH![]() 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是________。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________。
(5)上述装置中还需补充的实验仪器或装置有________![]() 填字母
填字母![]() 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mgL-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________。
(7)处理后的废水中氰化钠的浓度为_______ mgL-1;处理后的废水是否达到排放标准?_______(填“是”或“否”)。
【答案】取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C 作安全瓶,防止倒吸 CN- + H2O2 + H2O = HCO3- + NH3↑ 将三颈烧瓶中产生的NH3及时排出,减少副反应的发生 ACD 滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失 0.147 是
【解析】
⑴取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,由物质性质及元素守恒可知酸式盐应为碳酸氢盐,气体为氨气。
⑶装置b的作用是作安全瓶,防止倒吸。
⑷将三颈烧瓶中产生的NH3及时排出,减少副反应的发生。
⑸上述装置中还需补充的实验仪器或装置有温度计、水浴装置、酒精灯。
⑹滴定终点的现象是滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀。
⑺先计算消耗AgNO3的物质的量,再根据方程式计算处理的废水中氰化钠的质量,再计算废水中氰化钠的含量。
⑴设计实验证明N、C元素的非金属性强弱为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C;故答案为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,由物质性质及元素守恒可知酸式盐应为碳酸氢盐,气体为氨气,该反应的离子方程式是:
CN- + H2O2 + H2O = HCO3- + NH3↑;故答案为:CN- + H2O2 + H2O = HCO3- + NH3↑。
⑶装置b的作用是作安全瓶,防止倒吸;故答案为:作安全瓶、防止倒吸。
⑷装置a中反应产生的气体需要持续通入装置c的原因是:将三颈烧瓶中产生的NH3及时排出,减少副反应的发生;故答案为:将三颈烧瓶中产生的NH3及时排出,减少副反应的发生。
⑸上述装置中还需补充的实验仪器或装置有温度计、水浴装置、酒精灯,故ACD正确;
故答案为:ACD。
⑹滴定终点的现象是:滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失;故答案为:滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失。
⑺消耗AgNO3的物质的量为1.00×10-4mol·L-1×1.50×10-3L=1.5×10-7mol,根据方程式Ag+ + 2CN- = [Ag(CN)2]-,处理的废水中氰化钠的质量为1.5×10-7mol×2×49 gmol-1 = 1.47×10-5g = 1.47×10-2mg,废水中氰化钠的含量为![]() ,小于0.50mgL-1,所以达到排放标准。故答案为:0.147;是。
,小于0.50mgL-1,所以达到排放标准。故答案为:0.147;是。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述不正确的是( )

A.a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
B.放电时,电子从a极经过负载流向b极
C.该电池持续放电时,离子交换膜需选用阴离子交换膜
D.电路中转移电子3NA时消耗氧气16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线, 由曲线分析下列判断正确的是( )
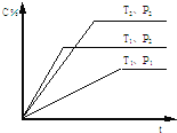
A.T1<T2,P1>P2,m+n>p,正反应吸热
B.T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D.T1>T2,P1<P2,m+n<p,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 溶液中,
溶液中,![]()
B.室温时水电离出来的![]() 的溶液中
的溶液中![]() 、
、![]() 、
、![]() 、
、![]() 一定能大量共存
一定能大量共存
C.等物质的量浓度的下列溶液:①![]() ②
②![]() ③
③![]() ④
④![]() 中
中![]() 的大小关系为:②>④>③>①
的大小关系为:②>④>③>①
D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH3COOH、HF均为弱酸,酸性强弱顺序为CH3COOH <HF,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
D.NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
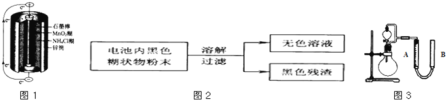
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=﹣lgc(OH﹣),298K时,向20.00 mL 0.10 molL﹣1氨水中滴入0.10 molL﹣1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )

A.曲线PJN表示溶液中pH的变化
B.M点水的电离程度比J点大
C.M、P两点的数值之和a+b=14
D.pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com