
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
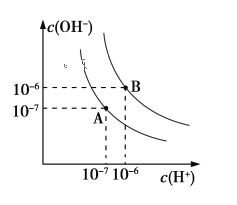
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
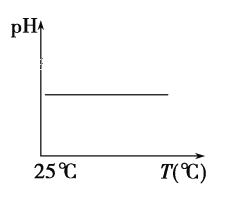
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
【答案】A 水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小 10︰1 a+b=14 弱 a HS-+H2O+CO2===H2S+HCO3- = A-+H2O ![]() HA+OH-
HA+OH-
【解析】
(1)曲线A对应的水的离子积常数是c(H+)×c(OH-)=10-14,曲线B对应的水的离子积常数是c(H+)×c(OH-)=10-12;
(2) 25 ℃时,pH=7说明硫酸和氢氧化钠恰好完全反应。
(3)根据图示,95 ℃时,水的离子积常数是10-12,强酸、强碱混合后溶液呈中性,则c(H+)×V(酸)=c(OH-) ×V(碱);
(4)曲线B对应的水的离子积常数是10-12,混合溶液的pH=5,呈酸性。
(5)根据图示,升高温度,溶液的pH不变,即氢离子浓度不变。
(6)根据电离平衡常数可知 ,酸性:H2CO3> H2S > HCO3-;CH3COOH和NH3·H2O电离平衡常数相等。
(7)25 ℃时, 0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好完全反应生成NaA。混合溶液的pH=8,说明NaA是强碱弱酸盐,A-水解。
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)均减小,水的离子积常数小,所以25 ℃时水的电离平衡曲线应为A;
(2) 25 ℃时,pH=7说明硫酸和氢氧化钠恰好完全反应,c(H+)×V(酸)=c(OH-) ×V(碱),10-4×V(酸)= 10-5 ×V(碱),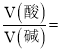
![]() ,NaOH溶液与pH=4的H2SO4溶液的体积比为10:1;
,NaOH溶液与pH=4的H2SO4溶液的体积比为10:1;
(3)根据图示,95 ℃时,水的离子积常数是10-12,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10-a×100= 10-12+b ×1;a+b=14;
(4)曲线B对应的水的离子积常数是10-12,若HA为强酸,则等体积混合后呈中性,pH=6,实际混合后溶液的pH=5,呈酸性,所以HA为弱酸;
(5) a.稀硫酸是强酸,加热稀硫酸,氢离子浓度不变,故选a;
b.氢氧化钠的强碱,加热NaOH溶液,氢氧根离子浓度不变,水的离子积常数增大,氢离子浓度增大,故不选b;
c.氯化钠是强电解质,溶液呈中性,加热NaCl 溶液,水的离子积常数增大,氢离子、氢氧根离子浓度均增大,故不选c;
d.氨水是弱碱,加热氨水,电离平衡正向移动,氢氧根离子浓度增大,氢离子浓度减小,故不选d;
e.醋酸是弱电解质,加热醋酸,电离平衡正向移动,氢离子浓度增大,故不选e;
故答案选a;
(6)根据电离平衡常数可知 ,酸性:H2CO3> H2S > HCO3-,少量CO2与NaHS反应生成硫化氢和碳酸氢钠,反应的离子方程式为HS-+H2O+CO2===H2S+HCO3-;CH3COOH和NH3·H2O电离平衡常数相等,所以铵根离子、醋酸根离子水解程度相同,室温下,CH3COONH4溶液的pH=7;
(7)25 ℃时,0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好完全反应生成NaA。混合溶液的pH=8,说明NaA是强碱弱酸盐,A-水解,离子方程式是A-+H2O HA+OH-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:可逆反应mA(g)+nB(g)pC(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线, 由曲线分析下列判断正确的是( )
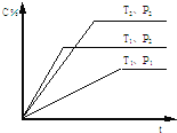
A.T1<T2,P1>P2,m+n>p,正反应吸热
B.T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D.T1>T2,P1<P2,m+n<p,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
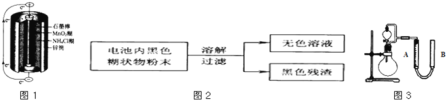
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某气体能使品红溶液褪色,则该气体是![]()
B.等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2;
Cu(NO3)2;
C.向某溶液中加入![]() 溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有
溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有![]()
D.向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象 | 解释 | |
A | 用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
D | 铁加入稀硝酸中有气泡产生 | 铁与稀硝酸发生了置换反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=﹣lgc(OH﹣),298K时,向20.00 mL 0.10 molL﹣1氨水中滴入0.10 molL﹣1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )

A.曲线PJN表示溶液中pH的变化
B.M点水的电离程度比J点大
C.M、P两点的数值之和a+b=14
D.pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___,基态磷原子中,电子占据的最高能层符号为___;该能层能量最高的电子云在空间有___个伸展方向,原子轨道呈___形。
(2)[Co(NO3-)4]2-中Co2+的配位数为4,配体中N的杂化方式为__,该配离子中各元素的第一电离能由小到大的顺序为___(填元素符号),1mol该配离子中含σ键数目为___NA。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
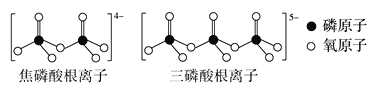
这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
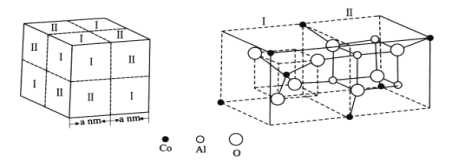
(4)钴蓝晶体结构如图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的___(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com