
【题目】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态Co原子核外电子排布式为___,基态磷原子中,电子占据的最高能层符号为___;该能层能量最高的电子云在空间有___个伸展方向,原子轨道呈___形。
(2)[Co(NO3-)4]2-中Co2+的配位数为4,配体中N的杂化方式为__,该配离子中各元素的第一电离能由小到大的顺序为___(填元素符号),1mol该配离子中含σ键数目为___NA。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
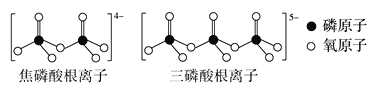
这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(4)钴蓝晶体结构如图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的___(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___g·cm-3(列计算式)。
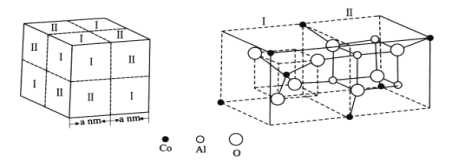
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 M 3 哑铃 sp2 Co、O、N 16 (PnO3n+1)(n+2)- CoAl2O4 八面体空隙 ![]()
【解析】
(1)Co为27号元素,Co原子核外有27个电子,根据核外电子排布规律可得其基态Co原子核外电子排布式;基态磷原子核外有三层电子,故最高能层符号为M,电子云在空间有3个伸展方向,原子轨道为哑铃型,故答案为:1s22s22p63s23p63d74s2或[Ar]3d74s2;M;3;哑铃;
(2)NO3-中价层电子对数为![]() ,故为sp2杂化;一般情况下非金属性越强第一电离能越大,但由于N原子中最外层为半充满状态,比较稳定,故第一电离能大于O,所以第一电离能由小到大的顺序为Co、O、N;一个NO3-中有3个σ键,配位键也为σ键,故σ键数目为3×4+4=16,则1mol该配离子中含σ键数目为16NA,故答案为:sp2;Co、O、N;16;
,故为sp2杂化;一般情况下非金属性越强第一电离能越大,但由于N原子中最外层为半充满状态,比较稳定,故第一电离能大于O,所以第一电离能由小到大的顺序为Co、O、N;一个NO3-中有3个σ键,配位键也为σ键,故σ键数目为3×4+4=16,则1mol该配离子中含σ键数目为16NA,故答案为:sp2;Co、O、N;16;
(3)可以根据磷酸根、焦磷酸根、三磷酸根的化学式推导:PO43-、P2O74-、P3O105-磷原子的变化规律为:1,2,3,4,n氧原子的变化规律为:4,7,10,3n+1 酸根所带电荷数的变化规律为:3,4,5,n+2;故答案为:(PnO3n+1)(n+2)-
(4)根据钴蓝晶体晶胞结构分析,一个晶胞中含有的Co、Al、O个数分别为:![]() ,
,![]() ,
,![]() ,所以化学式为CoAl2O4;根据结构观察,晶体中Al3+占据O2-形成的八面体空隙;该晶胞的体积为
,所以化学式为CoAl2O4;根据结构观察,晶体中Al3+占据O2-形成的八面体空隙;该晶胞的体积为![]() ,该晶胞的质量为
,该晶胞的质量为![]() ,所以密度为
,所以密度为 ![]() ,故答案为:CoAl2O4;八面体空隙;
,故答案为:CoAl2O4;八面体空隙;![]() 。
。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
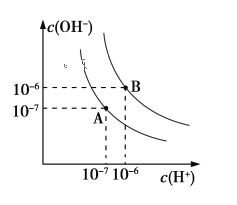
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
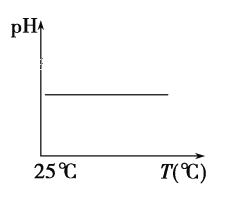
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是
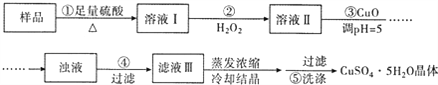
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
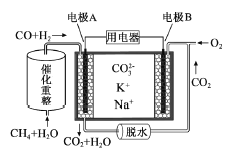
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
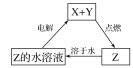
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M: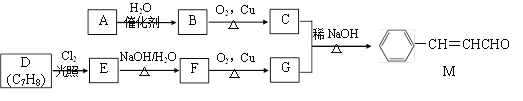
已知以下信息:
①A的相对分子质量为28
回答下列问题:
(1)A的名称是___________,D的结构简式是___________。
(2)A生成B的反应类型为________,C中官能团名称为___________。
(3)E生成F的的化学方程式为___________。
(4)下列关于G的说法正确的是___________。(填标号)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.可与新制的Cu(OH)2共热生成红色沉淀
d.G分子中最多有14个原子共平面
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。
①与化合物M含有相同的官能团;②苯环上有两个取代基
(6)参照上述合成路线,化合物X与Y以物质的量之比2:1反应可得到化合物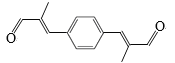 ,X的结构简式为________,Y的结构简式为________。
,X的结构简式为________,Y的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1mol C4H10中含共价键数目为14NA
B.某反应的ΔH = -88kJmol-1,则正反应活化能一定小于88kJmol-1
C.已知某温度下,Kw = 1×10-13,若将pH =8的NaOH溶液与pH =5的H2SO4溶液混合保持温度不变,欲使混合溶液pH =7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1molL-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时有三瓶溶液:
时有三瓶溶液:![]() 的盐酸、
的盐酸、![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液,下列说法正确的是( )
的氢氧化钠溶液,下列说法正确的是( )
A.中和等体积![]() 的氢氧化钠溶液,所需
的氢氧化钠溶液,所需![]() 醋酸溶液的体积大于
醋酸溶液的体积大于![]() 盐酸的体积
盐酸的体积
B.等体积![]() 盐酸和
盐酸和![]() 醋酸溶液中分别加入少量相同的锌粒,盐酸中锌粒先反应完
醋酸溶液中分别加入少量相同的锌粒,盐酸中锌粒先反应完
C.当![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液混合得到
的氢氧化钠溶液混合得到![]() 的溶液时,该溶液中
的溶液时,该溶液中![]() 大于
大于![]()
D.![]() 时
时![]() 的盐酸、
的盐酸、![]() 的醋酸溶液中水电离出的
的醋酸溶液中水电离出的![]() 均为
均为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com