
【题目】下列说法正确的是
A.某气体能使品红溶液褪色,则该气体是![]()
B.等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2;
Cu(NO3)2;
C.向某溶液中加入![]() 溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有
溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有![]()
D.向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有![]()
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将下列性质的编号,填入各小题后面对应的横线中:
A.脱水性;B.强酸性;C.氧化性;D.吸水性
①将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 ______
②在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 ______
③在冷浓HNO3中放入铝片没明显现象. ______
④用稀硫酸清洗金属表面的氧化物。 ______
(2)矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石(KAlSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此反应的离子方程式为:2KAlSi3O8 +2 CO2 +7H2O = 2K+ + 2HCO3-+ 4H2SiO3 + Al2Si2O5(OH)4,这个反应能够发生的原因是 ______ 。
(3)为了验证木炭和浓H2SO4反应生成的CO2、SO2,选用下图所示仪器(内含物质)组装成实验装置:(每组只能选一次,不能重复选)
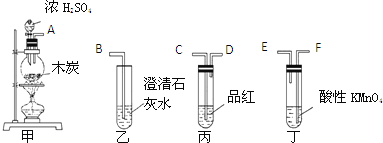
①如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):______ 接 ______ , ______ 接 ______ , ______ 接 ______ ;
②有怎样的实验现象才表明已检验出CO2? ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
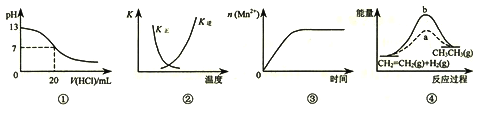
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
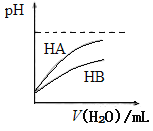
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.如上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
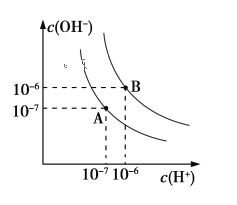
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
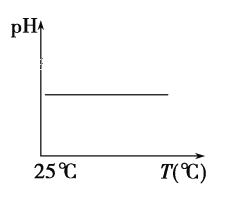
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )
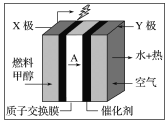
A.Y极为电池的负极
B.X极的电极反应式:CH3OH+H2O-6e-=CO2+6H+
C.若常温下用该电池电解100 mL KCl溶液至pH=12时,电池质子交换膜迁移的A为0.01 mol
D.空气以20%为氧气计算,X极每消耗1 mol甲醇,Y极必消耗168 L空气中的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )
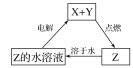
A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是氯化钠 D. Z可能是三氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com