
【题目】下列有关说法不正确的是
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
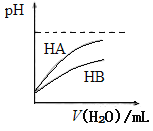
B.如上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应
【答案】B
【解析】
A、将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,恰好完全反应,得到醋酸钠溶液,醋酸根离子水解,使溶液显碱性,A正确;
B、pH相同的HA与HB两种酸稀释相同的倍数时,HA的pH增大的多,说明HA的酸性比HB的酸性强,根据盐水解的越弱越水解规律,则同浓度的NaA溶液与NaB溶液相比,后者溶液的碱性强,pH较大,B错误;
C、25℃时,pH=2的1.0L醋酸溶液中氢离子的浓度是10-2mol/L,则溶液中氢氧根离子的浓度是10-12mol/L,氢氧根离子来自水的电离,水电离产生的氢离子与氢氧根离子相等,所以水电离产生的氢离子浓度是数目为10-12mol/L,溶液体积为1.0L时,数目是10-12NA,C正确;
D、根据反应自发进行的条件,焓减熵增时一定自发,吸热反应为焓增的反应,若自发进行,则一定是熵增的反应,D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】某溶液X含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,已知该溶液中各离子物质的量浓度均为
中的几种,已知该溶液中各离子物质的量浓度均为![]() 不考虑水的电离及离子的水解
不考虑水的电离及离子的水解![]() 。为确定该溶液中含有的离子,现进行了如下的操作:
。为确定该溶液中含有的离子,现进行了如下的操作:
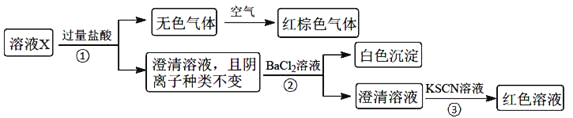
下列说法正确的是![]()
A.无色气体可能是NO和![]() 的混合物
的混合物
B.由步骤![]() 可知,原溶液肯定存在
可知,原溶液肯定存在![]()
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(![]() )增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是
)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是

A. 该温度下Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体,立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(![]() )∶c(
)∶c(![]() )=25
)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向右移动,c(H+)减小
B.加入少量CH3COONa固体,平衡向右移动
C.加入水时,平衡向右移动,CH3COOH电离常数增大
D.加入少量pH=5的硫酸,溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某气体能使品红溶液褪色,则该气体是![]()
B.等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2;
Cu(NO3)2;
C.向某溶液中加入![]() 溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有
溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中不一定有![]()
D.向某溶液中加入NaOH并加热,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含![]() 的溶液中,可能还存在
的溶液中,可能还存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子中的一种或几种.进行以下实验
六种离子中的一种或几种.进行以下实验
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向橙黄色溶液中加入![]() 溶液时,无沉淀生成;
溶液时,无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
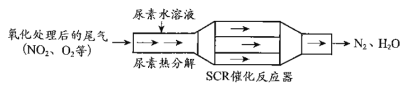
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
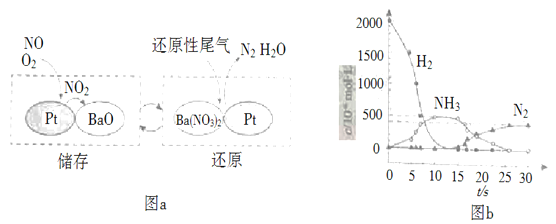
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
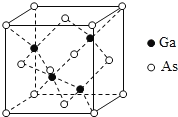
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com