
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
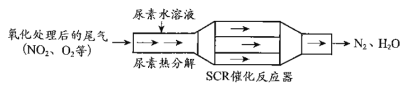
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
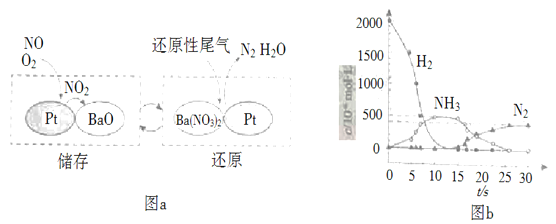
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
【答案】CO(NH2)2+H2O![]() CO2+2NH3 8NH3+6NO2
CO2+2NH3 8NH3+6NO2![]() 7N2+12H2O 2SO2+O2+4NH3+2H2O=2(NH4)2SO4
7N2+12H2O 2SO2+O2+4NH3+2H2O=2(NH4)2SO4 ![]() Ba(NO3)2 10∶3 415NO+4NH3+3O2
Ba(NO3)2 10∶3 415NO+4NH3+3O2![]() 415NNO+6H2O
415NNO+6H2O
【解析】
(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,结合原子守恒配平书写化学方程式;
②反应器中NH3还原NO2生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2是还原剂,氧气是氧化剂,结合电子守恒和原子守恒可得此反应的化学方程式;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4,2NaOH+H2SO4=Na2SO4+H2O,由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),以此计算;
(2)①由图a可知储存NOx的物质是BaO;
②第一步反应中H2被氧化生成水,化合价由0价升高到+1价,Ba(NO3)2的N元素化合价由+5价降低到-3价,生成氨气,结合得失电子数目相等计算;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,结合电子得失相等配平方程式。
(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,反应物为尿素和水,反应生成物为氨气和水,原子守恒书写化学方程式为:CO(NH2)2+H2O![]() CO2+2NH3;
CO2+2NH3;
②NH3在催化剂作用下还原NO2生成氮气和水,根据电子守恒、原子守恒,可得反应的化学方程式为8NH3+6NO2![]() 7N2+12H2O;
7N2+12H2O;
③SO2在O2作用下与NH3、H2O反应形成(NH4)2SO4,此反应中SO2中的S元素化合价升高,SO2作还原剂,氧气作氧化剂,反应的化学方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4;
④涉及反应为2NH3+H2SO4=n(NH4)2SO4,2NaOH+H2SO4=Na2SO4+H2O,反应中n(H2SO4)=v1×c1×10-3mol,n(NaOH)=v2×c2×10-3mol,由方程式可知n(NaOH)+n(NH3)=2n(H2SO4),所以n(NH3)=(2×v1×c1×10-3- v2×c2×10-3) mol,则根据N元素守恒可得n[CO(NH2)2]=![]() n(NH3),所以m[CO(NH2)2]=
n(NH3),所以m[CO(NH2)2]=![]() n(NH3)=
n(NH3)=![]() (2×v1×c1×10-3- v2×c2×10-3) mol×60g/mol=(0.06v1c1-0.03v2c2)g,所以原尿素溶液中溶质的质量分数是
(2×v1×c1×10-3- v2×c2×10-3) mol×60g/mol=(0.06v1c1-0.03v2c2)g,所以原尿素溶液中溶质的质量分数是![]() ×100%=
×100%=![]() ;
;
(2)①由图示可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再还原为N2,则储存NOx的物质为BaO;
②第二步反应中NH3被氧化生成水和N2,N化合价由-3价升高到0价,Ba(NO3)2的N元素化合价由+5价降低到0价,生成氮气,则1mol Ba(NO3)2生成氮气转移10mol电子,参加反应的氨气的物质的量为![]() mol,则消耗的NH3与Ba(NO3)2的物质的量之比是
mol,则消耗的NH3与Ba(NO3)2的物质的量之比是![]() :1=10:3;
:1=10:3;
③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知15NO与NH3应为1:1,可知反应的化学方程式为415NO+4NH3+3O2![]() 415NNO+6H2O。
415NNO+6H2O。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:
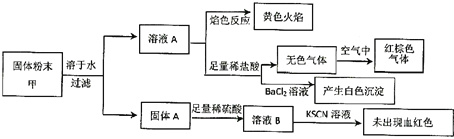
该同学得出的结论正确的是( )
A.固体粉末中含有钠元素,但不含钾元素
B.固体粉末中至少含有Na2SO4、K2SO3中的一种
C.固体粉末中至少含有KNO3、NaNO2中的一种
D.固体粉末中可能含有K2CO3、不含Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是_______________。
Ⅱ.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)—空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
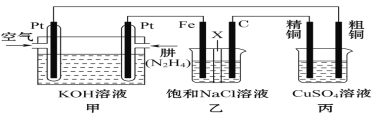
根据要求回答相关问题:
(2)甲装置中通入_________气体的一极为正极,负极的电极反应式为__________。
(3)乙装置中石墨电极为______极,其电极反应式为___________;可以用______________检验该反应产物,电解一段时间后,乙池中的溶液呈__________性。
(4)图中用丙装置模拟工业中的_____________________原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为____________g。
(5)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.0100mol·L-1的NaOH溶液滴入浓度为0.0100mol·L-1,体积为20.00mL的CH3COOH溶液.在滴加过程中n(CH3COOH)和n(CH3COO-)随溶液pH的分布关系如图。下列说法不正确的是( )
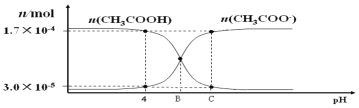
A.pH=4时,醋酸的电离常数Ka≈1.8×10-5
B.B点时,c(CH3COOˉ)=c(CH3COOH)
C.B点时,在溶液中滴入酚酞试剂,溶液显红色
D.C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,试写出对应的热化学方程式___________________。标准状况下11.2L氢气在氯气中充分燃烧放出的热量是______kJ。
(2)A(g)+B(g)![]() C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
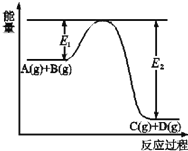
①反应物A(g)和B(g)具有的总能量_______(填大于、小于、等于)生成物C(g)和D(g)具有的总能量。
②该反应是_______反应(填吸热、放热),△H=_____(用E1和E2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com