
【题目】某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、Fe、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取甲进行连续实验。实验过程及现象如下:
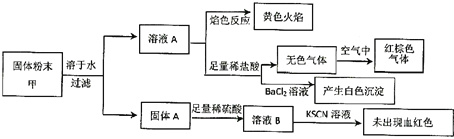
该同学得出的结论正确的是( )
A.固体粉末中含有钠元素,但不含钾元素
B.固体粉末中至少含有Na2SO4、K2SO3中的一种
C.固体粉末中至少含有KNO3、NaNO2中的一种
D.固体粉末中可能含有K2CO3、不含Fe2O3
【答案】C
【解析】
A、焰色反应呈黄色,说明含有钠元素,则至少含有NaNO2、Na2SO4中的一种,因未透过蓝色钴玻璃,不能确定是否含有钾元素,A错误;
B、若固体粉末含有K2SO3,无Na2SO4,则可能存在KNO3、NaNO2:2H++2NO3-+3SO32-=3SO42-+2NO↑+H2O,2H++2NO2-+SO32-=SO42-+2NO↑+H2O,对应的现象都是先产生无色气体,接触空气后才变为红棕色;若固体粉末无K2SO3,含有Na2SO4,溶液中无还原性物质,KNO3是不会反应生成NO的,而KNO2遇到酸发生分解生成NO和NO2,气体不需要接触空气就呈红棕色,不符合实验现象,故固体粉末中一定有K2SO3,无法推出Na2SO4的存在情况,B错误;
C、由B选项的分析可知,固体粉末中至少含有KNO3、NaNO2中的一种,C正确;
D、根据实验现象,不能推出K2CO3的存在情况;若固体粉末中含有Fe、Fe2O3,且Fe的量较多,则会发生反应:Fe+2Fe3+=3Fe2+,再加入KSCN溶液,溶液不会出现血红色,则不能说明不含Fe2O3,D错误;
故选C。


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】已知烃A的分子式为C6H12,分子中含有碳碳双键,且仅有一种类型的氢原子,在下面的转化关系中,D1、D2互为同分异构体,E1、E2互为同分异构体。
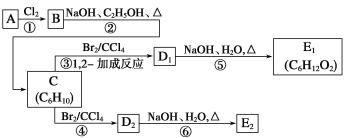
(1)反应②的化学方程式为
___________________________________________________________;
(2)C的化学名称是_____________________________;E2的结构简式是_______________________;
(3)④、⑥的反应类型依次是_________________________、__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:
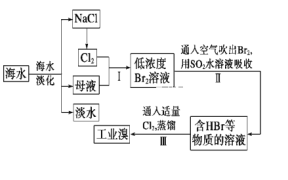
(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 ![]() 的化学平衡状态,相关数据如下:M:
的化学平衡状态,相关数据如下:M:![]() ; 2min达到平衡,生成
; 2min达到平衡,生成![]() ,测得从反应开始到平衡C的速率为
,测得从反应开始到平衡C的速率为![]() ;N:
;N:![]() ;达到平衡时
;达到平衡时![]() 下列推断的结论中不正确的是( )
下列推断的结论中不正确的是( )
A.![]() B.平衡时M中
B.平衡时M中![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:
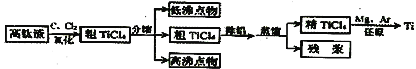
氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
沸点/℃ | 136 | 310 | 56.5 | 180 |
下列说法不正确的是( )
A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液
B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3
C.己知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去
D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科学家们-直致力于污染物的有效消除。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
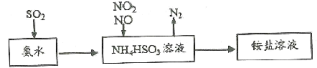
请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_________________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①己知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ· mol-1
2SO2(g)+O2(g)=2SO3(l) △H2=-288.4kJ· mol-1
N2(g)+O2(g)![]() 2NO(g) △H3=+180.5kJ· mol-1
2NO(g) △H3=+180.5kJ· mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(l) △H4,在低温下能否自发进行_______(填“能”或“否”),理由是__________________________。
②己知TiO2催化尾气降解原理为:
2CO(g)+O2(g)![]() 2CO2(g);2H2O(g)+4NO(g)+3O2(g)
2CO2(g);2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g)
4HNO3(g)
i、在一定条件下,模拟CO、NO的降解,得到降解率(即转化率)随时间变化如图所示,
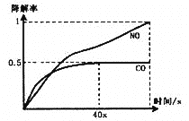
反应40秒后检测到混合气体中N2浓度上升,HNO3气体浓度有所降低,请用化学方程式并结合化学反应原理知识解释可能的原因____________________________________________。
ii,沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合图表回答下列问题:
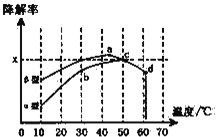
已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________(用含x的代数式表示);以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10~60℃范围内进行实验,请在图中用线段与阴影,仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )_____________________。
)_____________________。
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2,b极的电极反应式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 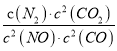 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
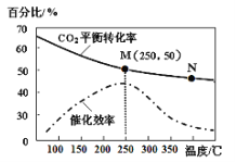
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
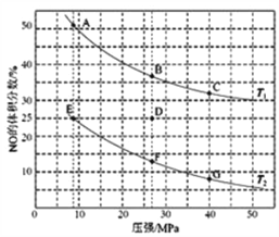
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。
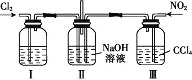
下列叙述正确的是
A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气
B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气
C. 装置Ⅲ的作用是便于控制通入NO2的量
D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
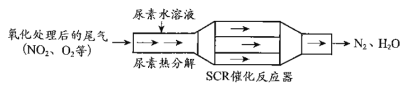
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________
②反应器中NH3还原NO2的化学方程式:________________________;
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________;
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________;
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
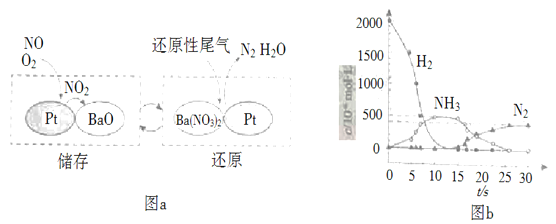
①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________;
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________;
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________![]() ____15NNO+___H2O
____15NNO+___H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com