
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 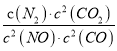 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
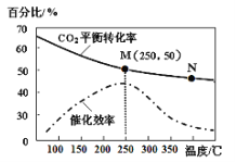
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
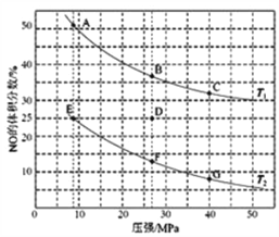
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5kJ/mol 2NO2 + 8e- =N2 + 4O2— ①③④ > 0.22或2.2×10-1 0.1 mol/(Lmin) A
【解析】试题分析:根据盖斯定律,写热化学方程式。
(2)电池的正极得电子发生还原反应。
(3) ①根据图示,M点催化剂催化效果最好;
②随温度升高,二氧化碳的平衡转化率减小;
③温度低于250℃时,随温度升高乙烯转化率减小;
④实际反应应从反应限度和反应速率两方面选择反应条件。
(2) ①2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol,升高温度平衡逆向移动,NO体积分数增大。
②利用“三段式”计算平衡常数;根据![]() 计算平均反应速率。
计算平均反应速率。
③若在D处对反应容器升温的同时扩大体积至体系压强减小,平衡逆向移动,NO体积分数增大。
解析:试题分析:若某反应的平衡常数表达式为: 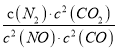 ,则方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g),根据盖斯定律,△ H=-746.5kJ/mol,热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
,则方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g),根据盖斯定律,△ H=-746.5kJ/mol,热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
(2) 电池的正极得电子发生还原反应,则正极反应式为2NO2 + 8e- =N2 + 4O2- 。
(3)①M点催化剂催化效果最好,所以M点的速率最大,故①错误;
②随温度升高,二氧化碳的平衡转化率减小,M点时平衡常数比N点时平衡常数大,故②正确;③温度低于250℃时,随温度升高乙烯的产率减小,故③错误;
④实际反应应尽可能在250℃下进行,提高单位时间的产量,故④错误。
(2)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
回答下列问题:
①2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol,升高温度平衡逆向移动,NO体积分数增大,所以T1>T2。
②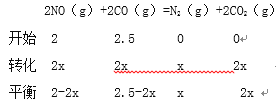
![]() ,x=0.5
,x=0.5
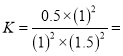 0.022 ;根据
0.022 ;根据![]() , 用CO的浓度变化表示的平均反应速率V(CO)=
, 用CO的浓度变化表示的平均反应速率V(CO)= ![]() 0.1 mol/(Lmin)。
0.1 mol/(Lmin)。
③若在D处对反应容器升温的同时扩大体积至体系压强减小,平衡逆向移动,NO体积分数增大,故选 A点。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某+2价离子的电子排布式为1s22s22p63s23p63d9 ,该元素在周期表中所属的族是
A. ⅠB B. ⅡB C. Ⅷ D. ⅡA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
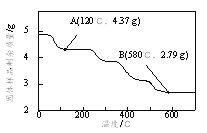
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(P)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
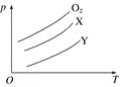
A. C2H4、CH4 B. CO2、Cl2
C. SO2、CO2 D. CH4、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:① NH3 ②浓硝酸 ③ 浓硫酸 ④ NO。其中,遇空气迅速变成红棕色的气体是____(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是____,加入蔗糖产生“黑面包”现象的溶液是____,常温下,能用铁制容器盛放的溶液是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是( )
A. H2CO3![]() 2H++CO32— B. NaHSO4===Na++H++SO42—
2H++CO32— B. NaHSO4===Na++H++SO42—
C. NaHCO3![]() Na++H++CO32— D. CH3COOH===H++CH3COO-
Na++H++CO32— D. CH3COOH===H++CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠与盐酸反应的比较。

(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的碳酸钠、碳酸氢钠粉末的小气球套在两支试管的管口。将气球内的碳酸钠和碳酸氢钠同时倒入试管中,观察到的实验现象是_________。
(2)实验结论是_____________________。
(3)碳酸钠与盐酸反应的化学方程式是____________,离子方程式是_________________。
(4)碳酸氢钠与盐酸反应的化学方程式是____________,离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,下列措施可以使c(CH3COOH)/c(H+)的值减小 的是
CH3COO-+H+,下列措施可以使c(CH3COOH)/c(H+)的值减小 的是
A. 加入水 B. 加入少量氢氧化钠固体
C. 加入少量冰醋酸 D. 加入少量醋酸钠固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com