
【题目】碳酸钠、碳酸氢钠与盐酸反应的比较。

(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的碳酸钠、碳酸氢钠粉末的小气球套在两支试管的管口。将气球内的碳酸钠和碳酸氢钠同时倒入试管中,观察到的实验现象是_________。
(2)实验结论是_____________________。
(3)碳酸钠与盐酸反应的化学方程式是____________,离子方程式是_________________。
(4)碳酸氢钠与盐酸反应的化学方程式是____________,离子方程式是__________。
【答案】两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大 碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈 Na2CO3+2HCl===2NaCl+H2O+CO2↑ CO32—+2H+=CO2↑+H2O NaHCO3+HCl===NaCl+H2O+CO2↑ HCO3—+H+===CO2↑+H2O
【解析】
与相同浓度的盐酸反应时,碳酸氢钠反应速率快,等质量的碳酸钠、碳酸氢钠,碳酸氢钠的物质的量大于碳酸钠,结合反应的方程式Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑、NaHCO3 + HCl=NaCl+H2O+CO2↑分析解答。
(1)与相同浓度的盐酸反应时,碳酸氢钠反应速率快,等质量的碳酸钠、碳酸氢钠,碳酸氢钠的物质的量大于碳酸钠,根据方程式Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑、NaHCO3 + HCl=NaCl+H2O+CO2↑可知碳酸氢钠放出的二氧化碳多,因此看到的现象为两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大,故答案为:两个气球均膨胀;碳酸氢钠与盐酸混合比碳酸钠与盐酸混合气体膨胀得快且大;
(2)根据(1)的分析,实验结论为碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈,故答案为:碳酸氢钠与盐酸反应产生气体比碳酸钠与盐酸反应产生气体多且剧烈;
(3)碳酸钠与盐酸反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;CO32-+2H+=CO2↑+H2O;
(4)碳酸氢钠与盐酸反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑;HCO3-+H+=CO2↑+H2O。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
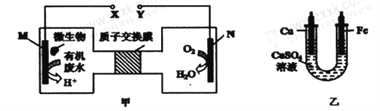
A. 铁电极应与Y相连接
B. H+透过质子交换膜由右向左移动
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 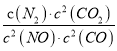 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
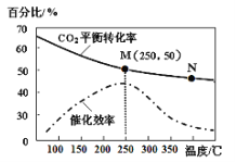
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
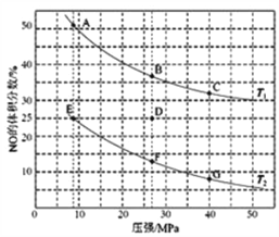
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质的变性是可逆过程 B. 氨基乙酸不能溶于强酸溶液中
C. 天然油脂没有恒定的熔点、沸点 D. 蔗糖的水解产物不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A.甲烷B.新戊烷C.乙烯D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是____________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是_________________________;
负极的电极反应式是_________________________。
(3)右图是一个电解过程示意图。
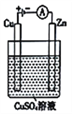
①锌片上发生的电极反应式是______________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知 2Na+O2![]() Na2O2,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2NaCO3+O2↑,下列灭火剂能用于扑灭金属钠着火的是()
Na2O2,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2NaCO3+O2↑,下列灭火剂能用于扑灭金属钠着火的是()
A. 干冰灭火剂 B. 水 C. 黄沙 D. 泡沫灭火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.氢氧化铝受热分解
D.将锌粒投入CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com