
【题目】下列物质在水溶液中的电离方程式正确的是( )
A. H2CO3![]() 2H++CO32— B. NaHSO4===Na++H++SO42—
2H++CO32— B. NaHSO4===Na++H++SO42—
C. NaHCO3![]() Na++H++CO32— D. CH3COOH===H++CH3COO-
Na++H++CO32— D. CH3COOH===H++CH3COO-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 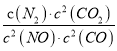 ,请写出此反应的热化学方程式___________________。
,请写出此反应的热化学方程式___________________。
(2)用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2-,则电池的正极反应式为_______。
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
CH2=CH2(g)+4H2O(g)己知不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是_______(填序号)。
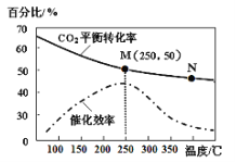
①不同条件下反应,N点的速率最大
②M点时平衡常数比N点时平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(4)在密闭容器中充入5mol CO和4mol NO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。
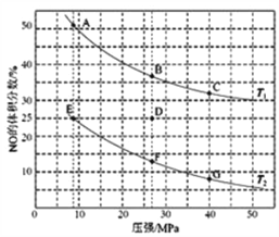
回答下列问题:
①温度:T1______ T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=______(保留两位有效数字);用CO的浓度变化表示的平均反应速率V(CO)=________。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:

注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
(1)反应Ⅰ中通入CO2需加压的原因是______。
(2)①反应Ⅱ生成LiOH的化学方程式为______。
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1,若固液比过低对后续操作的不利影响是______。

(3)浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
①LiOH·H2O中常含有少量的Li2CO3,但该物质对所制Li2O得纯度无影响,其原因是______。
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是______。铁坩埚中发生反应的化学方程式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质的变性是可逆过程 B. 氨基乙酸不能溶于强酸溶液中
C. 天然油脂没有恒定的熔点、沸点 D. 蔗糖的水解产物不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是____________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式是_________________________;
负极的电极反应式是_________________________。
(3)右图是一个电解过程示意图。
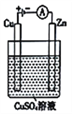
①锌片上发生的电极反应式是______________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是化合反应,又是氧化还原反应的是
A. 生石灰与水反应:CaO+ H2O =Ca(OH)2
B. 氯气通入溴化钠溶液:C12+2NaBr= 2NaCl+Br2
C. 铁和氯气反应:2Fe+3Cl2![]() 2FeC13
2FeC13
D. 氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com