
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色)△H<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到平衡状态
B. b点与a点相比,c(NO2)、c(N2O4)均减小
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
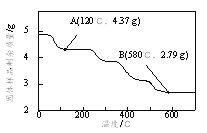
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(P)与温度(T)的关系如图所示,则X、Y气体可能分别是( )
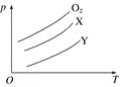
A. C2H4、CH4 B. CO2、Cl2
C. SO2、CO2 D. CH4、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是( )
A. H2CO3![]() 2H++CO32— B. NaHSO4===Na++H++SO42—
2H++CO32— B. NaHSO4===Na++H++SO42—
C. NaHCO3![]() Na++H++CO32— D. CH3COOH===H++CH3COO-
Na++H++CO32— D. CH3COOH===H++CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究温度对一氧化碳还原氧化铁的影响。
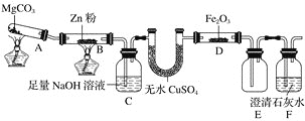
(1)MgCO3的分解产物为____________。
(2)装置C的作用是______________,处理尾气的方法为______________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒类喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验。已知Fe2+与K3[Fe(CN)6](铁氰化钾)溶液反应生成带有特征蓝色的铁氰化亚铁沉淀。
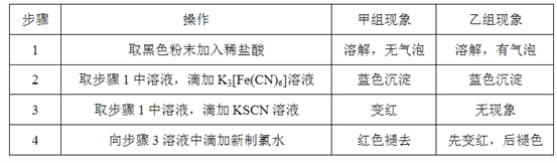
①乙组得到的黑色粉末是______________。
②甲组步骤1中反应的离子方程式为______________。
③乙组步骤4中,溶液变红的原因为______________________;溶液褪色可能的原因及其验证方法为________________________。
④从实验安全考虑,题图装置还可采取的改进措施是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com