
【题目】某溶液X含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,已知该溶液中各离子物质的量浓度均为
中的几种,已知该溶液中各离子物质的量浓度均为![]() 不考虑水的电离及离子的水解
不考虑水的电离及离子的水解![]() 。为确定该溶液中含有的离子,现进行了如下的操作:
。为确定该溶液中含有的离子,现进行了如下的操作:
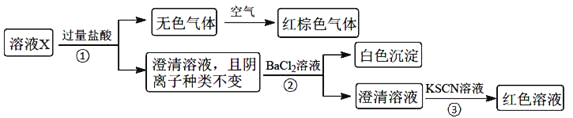
下列说法正确的是![]()
A.无色气体可能是NO和![]() 的混合物
的混合物
B.由步骤![]() 可知,原溶液肯定存在
可知,原溶液肯定存在![]()
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为![]()
【答案】D
【解析】
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,应为Fe2+,则溶液中一定不存在CO32-、OH-、SiO32-,都与Fe2+反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,结合各离子物质的量浓度均为![]() 解答该题。
解答该题。
溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有![]() 和还原性离子,应为
和还原性离子,应为![]() ,则溶液中一定不存在
,则溶液中一定不存在![]() 、
、![]() 、
、![]() ,都与
,都与![]() 反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有
反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有![]() ,加入氯化钡生成白色沉淀,则一定含有
,加入氯化钡生成白色沉淀,则一定含有![]() ,加入KSCN溶液呈红色,因
,加入KSCN溶液呈红色,因![]() 被氧化成
被氧化成![]() ,则不能证明X中含有
,则不能证明X中含有![]() ,则溶液中一定存在的离子有
,则溶液中一定存在的离子有![]() 、
、![]() 、
、![]() 、
、![]() ,溶液中各离子物质的量浓度均为
,溶液中各离子物质的量浓度均为![]() ,则还应含有
,则还应含有![]() 、
、![]() 、
、![]() 、
、![]() 中的离子,结合电荷守恒可知,应含有
中的离子,结合电荷守恒可知,应含有![]() ,则:
,则:
A.无色气体只能为NO,故A错误;
B.由以上分析可知不含![]() ,故B错误;
,故B错误;
C.溶液X中所含离子有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共5种,故C错误;
,共5种,故C错误;
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,可得到0.01molFe2O3和0.02molMgO,二者质量共为![]() ,故D正确;
,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下面几种烷烃的球棍模型


(1)与C互为同系物的是__,与C互为同分异构体的是__。
(2)在烷烃的同系物中,随碳原子数增加,其熔、沸点依次___(其中碳原子数满足__条件的烷烃常温下呈气态),液态时密度依次__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应①:O3![]() O2+[O] ΔH>0 平衡常数为K1;
O2+[O] ΔH>0 平衡常数为K1;
反应②: [O]+O3![]() 2O2 ΔH<0 平衡常数为K2;
2O2 ΔH<0 平衡常数为K2;
总反应: 2O3![]() 3O2 ΔH<0 平衡常数为K。
3O2 ΔH<0 平衡常数为K。
下列叙述正确的是( )
A. 降低温度,K减小 B. K=K1+K2
C. 适当升温,可提高消毒效率 D. 压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释或结论都正确的是![]()
![]()
A.向浓度均为![]() 的
的![]() 、
、![]() 混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明
混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明![]()
B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有![]()
C.向![]() 溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
D.某待测溶液可能含有等浓度的下列离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有
。现取少量待测溶液于试管,加入足量NaOH溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有![]() 、
、![]() ,需通过焰色反应确定
,需通过焰色反应确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
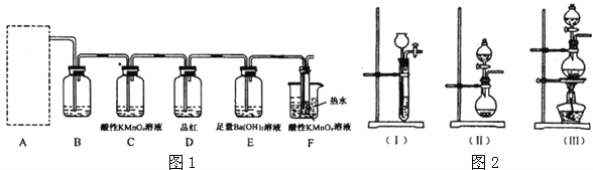
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
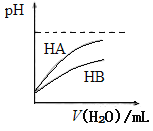
A.将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性
B.如上图可表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
C.25℃时,pH=2的1.0 L醋酸溶液中水电离出的H+的数目为10-12NA
D.某吸热反应能自发进行,则该反应一定是熵增的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com