
����Ŀ������A��B��C��D��E��Fԭ�������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڣ�BԪ�غ���3���ܼ�����ÿ���ܼ������ĵ�������ͬ��D��ԭ�Ӻ�����8���˶�״̬��ͬ�ĵ��ӣ�EԪ����FԪ�ش���ͬһ�������ڵ��壬���ǵ�ԭ���������3����EԪ�صĻ�̬ԭ����4��δ�ɶԵ��ӣ���ش��������⣺
����д����D��̬ԭ�ӵļ۲������ͼ�� ______ ��F��̬ԭ�ӵ���Χ�����Ų�ʽ�� ______ ��
������˵��������� ______ ��
A.�����������Է��������ȶ�����̼�����Էе㣺SiO2 > CO2
B.�縺��˳��B < C < D
C.N2��COΪ�ȵ����壬�ṹ����
D.�ȶ��ԣ�H2O > H2S��ˮ���Ӹ��ȶ���ԭ����ˮ���Ӽ�������
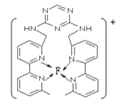
��F�����������ڶ���ø�ĸ����ӣ��˹�ģ��ø�ǵ�ǰ�о����ȵ㣬��F����������Һ��ͨ�������C��A�γɵ�����X������(F(X)4)2+�������ӵĽṹʽΪ ______ ![]() ��Ԫ�ط��ű�ʾ
��Ԫ�ط��ű�ʾ![]() ��
��
��ij��������F(I)(����ʾ���ϼ�Ϊ+1)����γ�ͼ��ʾ�����ӣ���������̼ԭ�ӵ��ӻ���ʽ�� ______ ��
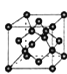
��B���ʵ�һ��ͬ��������ľ�����ͼ2��ʾ����һ������������Bԭ����Ϊ ______ ��
��D��F�γ����Ӹ�����Ϊ1��1�Ļ����������NaCl���ƣ���D���ӵİ뾶Ϊapm��F���ӵİ뾶bpm����þ����Ŀռ������� ______ ��
���𰸡�![]() 3d104s1 AD
3d104s1 AD 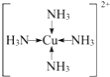 sp2��sp3 8
sp2��sp3 8 
��������
A��B��C��D��E��Fԭ�������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڣ�BԪ�غ���3���ܼ�����ÿ���ܼ������ĵ�������ͬ��ԭ�Ӻ�������Ų�Ϊ1s22s22p2����BΪCԪ�أ�D��ԭ�Ӻ�����8���˶�״̬��ͬ�ĵ��ӣ���DΪOԪ�أ�Cԭ����������̼����֮�䣬��CΪNԪ�أ�EԪ����FԪ�ش���ͬһ�������ڵ��壬���ǵ�ԭ���������3��Ӧ�������弰���ڵ��壬EԪ�صĻ�̬ԭ����4��δ�ɶԵ��ӣ���Χ�����Ų�Ϊ3d64s2����EΪFe����FΪCu������C��A�γɵ�����X����AΪHԪ�أ�XΪNH3��
��DΪOԪ�أ���̬ԭ�ӵļ۲�����Ų�ͼ��![]() ��FΪCuԪ�أ���̬ԭ�ӵ���Χ�����Ų�ʽΪ��3d104s1���ʴ�Ϊ��
��FΪCuԪ�أ���̬ԭ�ӵ���Χ�����Ų�ʽΪ��3d104s1���ʴ�Ϊ��![]() ��3d104s1��
��3d104s1��
��Aѡ��е㣺SiO2 > CO2�������ڶ�����������ԭ�Ӿ��壬������̼�γɷ��Ӿ��壬��A����Bѡ�ͬ������ԭ����������縺�����ʵ縺��˳��C < N < O����B��ȷ��Cѡ�N2��CO���Ӷ�����2��ԭ�ӡ��۵�����������10������Ϊ�ȵ����壬�ṹ���ƣ���C��ȷ��Dѡ��ȶ��ԣ�H2O > H2S������Ϊ�ǽ�����O > S�������֮���������أ���D����������������Ϊ��AD��
��C��A�γɵ�����X����AΪHԪ�أ�XΪNH3��F��������ΪCuSO4����CuSO4��Һ��ͨ�������NH3������[Cu(NH3)4]2+�������ӵĽṹʽΪ��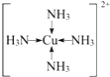 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���ӻ��ϵ�̼ԭ�Ӻ���3��������û�й¶Ե��ӣ�����sp2�ӻ����Ǽ���̼ԭ�Ӻ���4�����۵���������sp3�ӻ����ʴ�Ϊ��sp2��sp3��
����B���ʵ�һ��ͬ��������ľ����ṹ��֪��Bԭ����4��λ�ھ����ڲ�������Bԭ��λ�ڶ��㡢���ģ���һ������������Bԭ����Ϊ![]() ���ʴ�Ϊ��8��
���ʴ�Ϊ��8��
��O��Cu�γ����Ӹ�����Ϊ1��1�Ļ�����ΪCuO��������NaCl���ƣ��侧���ṹΪ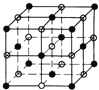 ��������ͭ������Ŀ
��������ͭ������Ŀ![]() ��������Ŀ
��������Ŀ![]() ��O2-���ӵİ뾶Ϊapm��Cu2+���ӵİ뾶bpm������ԭ�������
��O2-���ӵİ뾶Ϊapm��Cu2+���ӵİ뾶bpm������ԭ�������![]() �������ⳤ
�������ⳤ![]() ���ʾ������
���ʾ������![]() ���ʸþ����Ŀռ�������
���ʸþ����Ŀռ������� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��


 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC8H8O3���л���������ұ�����������ȡ����������һ��ȡ����Ϊ-OH�뱽��ֱ����������һ��ȡ������![]() �ṹ���ţ�ͬʱ��������Ҫ�������ͬ���칹�干�У������������칹���� ��
�ṹ���ţ�ͬʱ��������Ҫ�������ͬ���칹�干�У������������칹���� ��
A.6B.9C.12D.15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��
��![]() ��
��![]() ��
��![]() Ϊԭ��������������Ķ�����Ԫ�أ�
Ϊԭ��������������Ķ�����Ԫ�أ�![]() Ϊ�ؿ��к�����ߵĹ��ɽ���Ԫ�أ�
Ϊ�ؿ��к�����ߵĹ��ɽ���Ԫ�أ�![]() ��
��![]() ͬ���壬
ͬ���壬![]() ��
��![]() ͬ���ڣ���
ͬ���ڣ���![]() ��
��![]() ��ԭ������֮��Ϊ20���ס��ҷֱ�ΪԪ��E��A�ĵ��ʣ� ������ΪA��E�ֱ���B�γɵĶ�Ԫ���������ת����ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��ԭ������֮��Ϊ20���ס��ҷֱ�ΪԪ��E��A�ĵ��ʣ� ������ΪA��E�ֱ���B�γɵĶ�Ԫ���������ת����ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
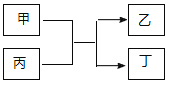
A.![]() ��
��![]() �γɵ�һ�ֻ��������Ư����
�γɵ�һ�ֻ��������Ư����
B.![]() ��
��![]() �γɵ����ӻ�������ܺ��зǼ��Լ�
�γɵ����ӻ�������ܺ��зǼ��Լ�
C.![]() �ĵ����������Ӧ�û���
�ĵ����������Ӧ�û���![]() �ĵ���
�ĵ���
D.��Ϊ��ɫ���壬��1mol������������Ӧת�Ƶ���3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����a��b���������������Ƶ���ζ��ĵζ����ߣ�����������ȷ����(����)

A.�������Ƶ����ʵ���Ũ��Ϊ1 mol��L-1
B.����b���������Ƶζ�����ĵζ�����
C.P��ʱ��Ӧǡ����ȫ����Һ������
D.��̪����������ʵ���ָʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӧ���ڴ�������ͨ���������������̽��еġ���ͼ���ҹ�ѧ�߷���T��Cʱ���״���CH3OH����ͭ�������ϵķ�Ӧ�������£�
��ӦI�� CH3OH(g)��CO(g)��2H2 (g) H1��akJ/mol
��Ӧ�� CO(g)��H2O(g)��CO2 (g)��H2 (g) H2��-bkJ/mol (b>0)
�ܷ�Ӧ�� CH3OH(g)��H2O(g)��CO2 (g)��3H2(g)H3�� ckJ/mol

�����й�˵������ȷ����(����)
A.��ӦI�Ƿ��ȷ�Ӧ
B.1mol CH3OH(g)��H2O(g)������������1mol CO2(g)��3mol H2(g)��������
C.c>0
D.�����Ĵ��������˷�Ӧ�Ļ�ܣ�������H3����Լ����Դ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ���ǰ������Ԫ��R��W��X��Y��Z��ԭ���������ε�����R��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��ӡ���ҵ��ͨ������Һ̬�������X���ʡ�Yԭ�ӵ���������������Ӳ���֮������R��W��X����Ԫ�ص�ԭ������֮�͡�Z��̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ�����������ӡ���ش�����������
��1�� Z2+��̬��������Ų�ʽΪ______________��
��2�� YX4-�Ŀռ乹����______________����YX4-��Ϊ�ȵ������һ�ַ���Ϊ_____________(�ѧʽ)��HYX4���Ա�HYX2ǿ����ԭ����_____________��
��3���ṹ��ʽΪRX (W2H3)2�Ļ�������Rԭ�ӵ��ӻ��������Ϊ_____________��lmo1RX (W2H3) 2�����к���������ĿΪ_____________��
��4����Z����������Һ��ͨ�������WH3��������[Z(WH3)4]SO4������˵����ȷ����_____________��
A. [Z(WH3)4]SO4�������Ļ�ѧ�������Ӽ������Լ�����λ��
B.��[Z(WH3)4]2+��Z2+�����¶Ե��ӣ�NH3�ṩ�չ��
C.��[Z(WH3)4]SO4���Ԫ���е�һ��������������Ԫ��
��5��ijY��Z�γɵĻ�����ľ�����ͼ��ʾ(�ڵ����Zԭ��)��

���þ���Ļ�ѧʽΪ_____________
����֪Z��Y�ĵ縺�Էֱ�Ϊ1.9��3.0����Y��L�γɵĻ���������_____________(��������������������)�����
����֪�þ�����ܶ�Ϊ��g.cm-3�������ӵ�����ΪNA����þ�����Zԭ�Ӻ�Yԭ��֮������̾���Ϊ_____________pm(ֻд����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪T��X��Y��Z����ѧ��ѧ����������Ԫ�أ���ṹ��������Ϣ���±���
Ԫ�� | �ṹ��������Ϣ |
T | ԭ�ӵ�L����s����������p������ |
X | Ԫ�ص�ԭ�Ӱ뾶�ǵ�����������Ԫ�������� |
Y | �����к��䵥�ʣ�ԭ�ӵ������δ�ɶԵ������Ǹ�Ԫ���������������� |
Z | ���ʳ��¡���ѹ�������壮ԭ�ӵ�M������1��δ�ɶԵ�p���� |
�������Ϣ�ش��й����⣺
��1��д����Y2��Ϊ�ȵ�����ķ���ʽ______________��
��2������ͬ״���£�Y�ļ��⻯��ķе����Z���⻯���ԭ����______________��
��3��T��X��Y����Ԫ�صĵ縺���ɴ�С��˳��(��Ԫ�ط���)��______________��
��4��Ԫ��Q��ԭ��������X��Z��ԭ������֮�ͣ�
�ٸ�Ԫ�ػ�̬ԭ�ӵ����������Ų�ʽΪ______________��
��Ԫ��Q��Ԫ��T��Y��Z�ֱ��γ�ƽ���͵�[Q(TY)4]2-���������[QZ4]2-������T��Y��Q��Z�ɼ�ʱ����ԭ�Ӳ��õ��ӻ���ʽ�ֱ���_________��___________��
��Ԫ��Q�γɵĵ��ʵľ���ṹ����ͼ��ʾ���þ����γ�ʱ��ԭ�Ӷѻ���ʽ��__________(ѡ������������������������)��
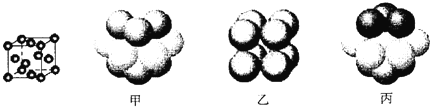
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص���������ȷ���ǣ� ��

A.a���ķ�Ӧʽ��N2H4+4OH����4e���TN2��+4H2O
B.�ŵ�ʱ�����Ӵ�a��������������b��
C.�õ�س����ŵ�ʱ�����ӽ���Ĥ��ѡ�������ӽ���Ĥ
D.��·��ת�Ƶ���3NAʱ��������16.8 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����淴ӦmA��g��+nB��g��pC��g�����ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��tʱ���¶�T��ѹǿP��������C�ڻ�����е�����ٷֺ����Ĺ�ϵ���ߣ� �����߷��������ж���ȷ���ǣ�������
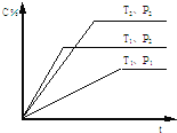
A.T1��T2��P1��P2��m+n��p������Ӧ����
B.T1��T2��P1��P2��m+n��p������Ӧ����
C.T1��T2��P1��P2��m+n��p������Ӧ����
D.T1��T2��P1��P2��m+n��p������Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com