
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
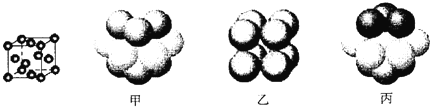
【答案】CO NH3分子间能形成氢键,而HCl分子间没有氢键 N>C>Na 3d84s2 sp sp3 丙
【解析】
T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素
(1)与N2互为等电子体的物质为CO;
(2)NH3分子间能形成氢键,而HCl分子间没有氢键,故NH3的沸点故HCl的沸点;
(3)非金属性越强,电负性越大,故电负性N>C>Na;
(4)元素Q的原子序数是Na与Cl的原子序数之和,则Q的原子序数为11+17=28,则Q为Ni元素;①Ni元素原子的核外电子排布式为1s22s22p63s23p63d84s2,其最外层电子排布为3d84s2;②平面型的[Ni(CO)4]2-和四面体的[NiCl4]2-,CO分子中C原子价层电子数为1+(4-2)/2=2,C原子采取sp杂化,[NiCl4]2-是四面体结构,Ni原子采取sp3杂化;③由图可知,Ni的晶体为面心立方堆积,即为“ABC”结构,原子堆积方式是为丙。
【点晴】
能结合元素的结构特点快速判断元素是解答关键。T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素,据此解答。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】完成下列化学方程式
(1)乙二醛与银氨溶液:___;
(2)苯酚钠溶液中通入少量CO2:___;
(3)足量乙酸与乙二醇发生酯化反应:___;
(4)乙醛与甲醇的加成反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
⑴请写出:D基态原子的价层电子排图: ______ ;F基态原子的外围电子排布式: ______ .
⑵下列说法错误的是 ______ .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.电负性顺序:B < C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O > H2S,水分子更稳定的原因是水分子间存在氢键
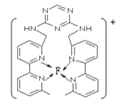
⑶F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点,向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+,该离子的结构式为 ______ ![]() 用元素符号表示
用元素符号表示![]() .
.
⑷某化合物与F(I)(Ⅰ表示化合价为+1)结合形成图所示的离子,该离子中碳原子的杂化方式有 ______ .
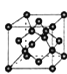
⑸B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 ______ .
⑹D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm,F离子的半径bpm,求该晶胞的空间利用率 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。

下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟从海水中制备NaOH溶液,其流程如图所示,下列有关说法正确的是
![]()
A.步骤一用到的仪器有坩埚、三脚架和泥三角
B.步骤二添加NaOH的目的是除去![]()
C.步骤二的过滤操作是在加入盐酸之后
D.步骤三最后一步反应为![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断正确的是![]()
A.整个过程共发生2个氧化还原反应
B.在该溶液中滴少量品红,品红褪色
C.所有离子的浓度都发生了变化
D.反应过程中氯气既作氧化剂又作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是 ( )
、Al3+、I-、Mg2+、Na+7种离子中的几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是 ( )
A.Al3+、Na+、S![]() 、I-B.Mg2+、Na+、CO
、I-B.Mg2+、Na+、CO![]() 、Br-
、Br-
C.Al3+、Mg2+、I-、SO![]() D.Al3+、CO
D.Al3+、CO![]() 、Br-、SO
、Br-、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com