
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
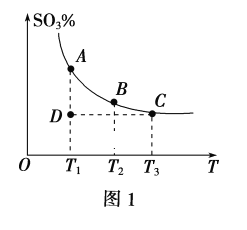
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡___(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正___(填“>”“<”或“=”)v逆。
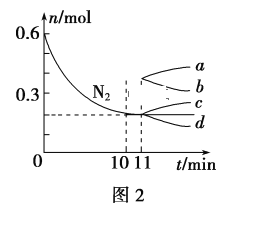
(2)已知N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
2NH3(g) ΔH<0,在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=__。从第11min起,压缩容器的体积为1L,则n(N2)的变化曲线为___(填编号)。
(3)298K时,将20mL3xmol·L-1 Na3AsO3、20mL3xmol·L-1I2和20 mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
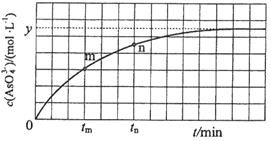
①下列可判断反应达到平衡的是___(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.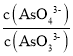 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正___v逆(填“大于”“小于”或“等于”)。
③tm时v逆___tn时v逆(填“大于”“小于”或“等于”),理由是___。
【答案】向左 > 0.06mol/(Lmin) d ac 大于 大于 tm时生成物浓度较低反应速率较慢
【解析】
(1)①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低;
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
(2)根据v=![]() 计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
计算v(N2),再根据速率之比等于化学计量数之比计算v(H2);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,达平衡是n(N2)减小;
(3)①达到平衡时,正逆反应速率相等,各物质的浓度不变;
②反应从正反应开始进行,tm时反应继续正向进行;
③物质的浓度越大,反应速率越大。
(1)①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,正逆反应速率都减小,压强降低平衡向体积增大方向移动,即向左移动;
②反应进行到状态D时,没有达到平衡状态,反应的趋势是向生成SO3的方向进行,即向正反应方向移动,则v正>v逆。
(2)由图2可知,0~10min内氮气的物质的量变化为0.6mol-0.2mol=0.4mol,所以v(N2)= =0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,则n(N2)的变化曲线选d;
=0.02mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(N2)=3×0.02mol/(Lmin)=0.06mol/(Lmin);压缩体积,增大压强,平衡向正反应移动,改变瞬间n(N2)不变,平衡时n(N2)减小,则n(N2)的变化曲线选d;
(3)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c.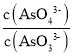 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c(AsO43-)=ymolL-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2ymolL-1,所以c(I-)=ymolL-1时没有达到平衡状态,故d错误;
故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正大于v逆
③tm时比tn时浓度更小,则逆反应速率更小,故tm时v逆小于tn时v逆。


科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是

A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法中不正确的是 ( )
A. “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致.
B. 加入Na2S可消除污水中Hg2+ 的污染。
C. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目
D. 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH![]()
![]() ,其过程符合绿色化学的原则
,其过程符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.宇宙星体、地球内部都处于高压状态,探究“高压下钠和锂单质金属![]() 绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持
绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持
B.工业、农业以及日常生活中产生的污水应当分开处理.常用的污水处理方法有中和法、氧化还原法、离子交换法、萃取法、吹脱法、吸附法、电渗析法等,其中前三种属于化学处理方法
C.新型炸药--![]() 塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性
塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性
D.建筑领域常使用的黏土、石英、白垩石和多用于农业和食品工业的硅藻土、硅胶均不属于硅酸盐材料的范畴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaHCO3溶液的说法正确的是( )
A.该溶液中,H+、Al3+、Cl-能大量共存
B.溶液中c(H2CO3)<c(CO32-)
C.该溶液中阳离子总数大于阴离子总数
D.常温下,加水稀释,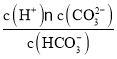 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是反应CO(g) +2H2(g) ![]() CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )

A.加入催化剂,该反应的△H变小
B.如果该反应生成液态CH3OH,则△H变大
C.该反应的△H=+91 kJ/moL
D.反应物的总能量大于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如下图中的两个循环可分别得到S和H2SO4,假设循环I、II处理等质量的SO2。下列说法正确的是

A. “反应1”和“电解”中的氧化产物分别是ZnFeO3.5和MnO2
B. “反应2”和“吸收”中的SO2均起还原剂的作用
C. 铁网或石墨均可作为循环II中电解过程中的阳极材料
D. 循环I、II中理论上分别得到S和H2SO4的物质的量比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为:
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论均正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 将水蒸气通过灼热的铁粉,粉末变红褐色 | 铁与水在高温下发生反应 |
B | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中不一定含有 |
C | 将某气体通入酸性高锰酸钾溶液中,溶液紫色褪去 | 该气体有还原性 |
D | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com