
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

【答案】取代反应 醛基和醚键 丙氨酸 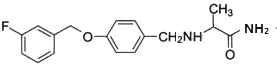 CH3CHO+NH3+HCN→CH3CH(NH2)CN+H2O
CH3CHO+NH3+HCN→CH3CH(NH2)CN+H2O  +HCHO→
+HCHO→ +H2O 5
+H2O 5 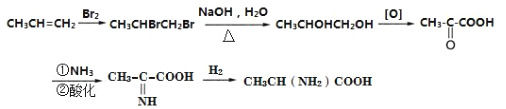
【解析】
CH3CHO、NH3、HCN和水在一定条件下合成A,反应为:CH3CHO+NH3+HCN→CH3CH(NH2)CN+H2O,结合信息①CH3CN 在酸性条件下可水解生成 CH3COOH,得A为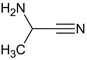 ,水解后生成
,水解后生成![]() ,中和后得到B,B为
,中和后得到B,B为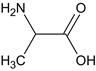 ,与SOCl2和CH3OH发生取代反应生成C,C为
,与SOCl2和CH3OH发生取代反应生成C,C为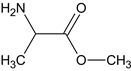 ,C与NH3反应生成D,D为
,C与NH3反应生成D,D为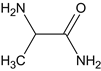 ,E和F生成G,G为
,E和F生成G,G为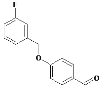 ,G和D反应生成
,G和D反应生成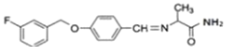 ,最加氢生成
,最加氢生成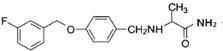 。
。
(1)C为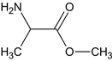 ,C与NH3反应生成D,D为
,C与NH3反应生成D,D为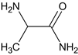 ,C 生成 D 的反应类型为取代反应,G为
,C 生成 D 的反应类型为取代反应,G为 ,G中含氧官能团的名称为醛基和醚键。B为
,G中含氧官能团的名称为醛基和醚键。B为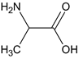 ,B 的名称为丙氨酸。
,B 的名称为丙氨酸。
故答案为:取代反应;醛基和醚键;丙氨酸;
(2)由沙芬酰胺的结构简式为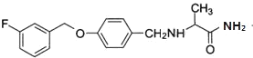 。
。
故答案为: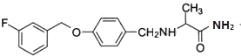 ;
;
(3)反应(1)的方程式CH3CHO+NH3+HCN→CH3CH(NH2)CN+H2O。分析反应(2)的特点,醛基和氨基反应生成碳氮双键和水,使蛋白质变性,用福尔马林浸制生物标本的反应原理的方程式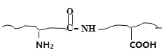 +HCHO→
+HCHO→+H2O。
故答案为:CH3CHO+NH3+HCN→CH3CH(NH2)CN+H2O; +HCHO→
+HCHO→![]() +H2O;
+H2O;
(4)H 是 F ![]() 相邻的同系物,H比F多一个碳原子,H 的苯环上有两个处于对位的取代基,①苯环上仍然有两个处于对位的取代基,②能与 NaOH 溶液反应,可能为酚
相邻的同系物,H比F多一个碳原子,H 的苯环上有两个处于对位的取代基,①苯环上仍然有两个处于对位的取代基,②能与 NaOH 溶液反应,可能为酚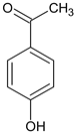 、
、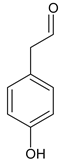 、
、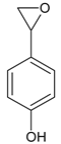 三种;酸
三种;酸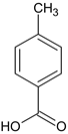 一种、和酯
一种、和酯 一种,共5种;
一种,共5种;
故答案为:5;
(5)根据题中信息设计的由丙烯为起始原料先与溴发生加成反应,得1,2-二溴丙烷,水解后生成1,2-丙二醇,氧化后生成![]() ,羰基可与NH3反应,最后与氢气加成可得产品,
,羰基可与NH3反应,最后与氢气加成可得产品,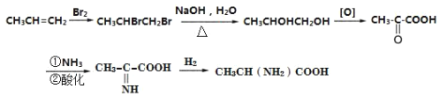 。
。
故答案为: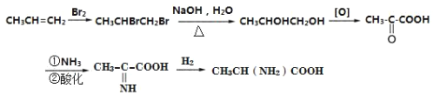 。
。


科目:高中化学 来源: 题型:
【题目】在进行锌铜双液原电池实验时,若用铜丝代替盐桥(如图),外电路中仍然存在较小的电流,随着时间 的推移,电流逐渐减小。下列关于该装置说法错误的是
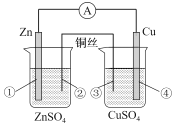
A.左池形成了原电池,Zn极的电势最高
B.铜丝②附近溶液的pH将升高
C.右池为电解池,铜丝③的反应式为 Cu-2eˉ=Cu2+
D.铜片④上有新的亮红色固体附着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数。回答下列问题:
(1)写出CH3COONa水解的离子方程式______。
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序______。
(3)25℃时,Ka(CH3COOH)______Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是______(填写选项字母)。
a.代谢产生的H+被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H2CO3中和转化为HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
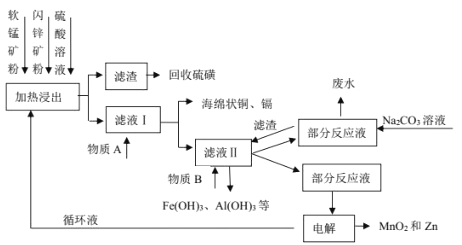
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
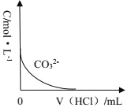
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于炔烃的说法中正确的是
A.分子中的碳原子不可能在同一直线上
B.分子中碳碳三键中的三个键的性质完全相同
C.分子组成符合CnH2n—2(n≥2)的链烃一定是炔烃
D.随着碳原子数增加,分子中碳的质量分数逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.128 g HI加热充分分解生成氢气的分子数为0.5NA
B.15 g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA
C.标准状况下,1.12 L氖气与1.12 L甲烷所含质子总数均为0.5NA
D.0.2mol![]() 与0.5mol
与0.5mol![]() 在光照下充分反应,产物中C—Cl键总数为0.5NA
在光照下充分反应,产物中C—Cl键总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置可确定有机物的化学式,其原理:在玻璃管内,用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
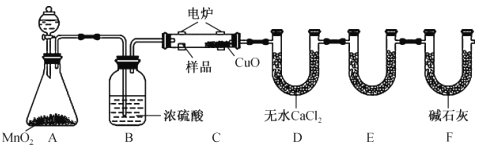
回答下列问题:
(1)装置B中的作用是____________________;若无B装置,则会造成测得的有机物中含氢量_________(填“偏大”“偏小”或“不变”)。
(2)装置E中所盛放的试剂是________ ,其作用为______________ 。
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为_______________。
(4)要确定该有机物的分子式,还需要测定_________________ 。
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或________ (填名称),可采取_______ 方法(填一种仪器分析法)确定该有机物具体是何种物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对X2 (g)+3Y2 (g)=2XY3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量),下列判断正确的是
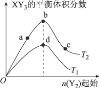
A.若T2>T1,则正反应一定是放热反应
B.T2和n (X2)不变,达到平衡时,XY3的物质的量:c>b>a
C.T2和n(X2)不变,达到平衡时,X2的转化率:b>a>c
D.若T2>T1,达到平衡时b、d点的正反应速率:v(d)>v (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaF溶液中F-的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com