
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.128 g HI加热充分分解生成氢气的分子数为0.5NA
B.15 g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA
C.标准状况下,1.12 L氖气与1.12 L甲烷所含质子总数均为0.5NA
D.0.2mol![]() 与0.5mol
与0.5mol![]() 在光照下充分反应,产物中C—Cl键总数为0.5NA
在光照下充分反应,产物中C—Cl键总数为0.5NA
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______,电子占据最高能级上的电子数为______。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________。
②1molCO2中含有的σ键数目为________,其中C原子的杂化方式为_________;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________。
③Na2O的熔点比NaF的高,其理由是:_________。
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________(填微粒符号)。
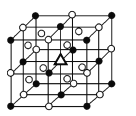
(4)冰晶石稀溶液中存在的化学键有________(填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:![]()
B. 2-甲基-2-戊烯的键线式:![]()
C. ![]() 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢大量存在于天然气及液化石油气中,近年来发现![]() 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解![]() 包括下列反应:
包括下列反应:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
①![]() =____________(用
=____________(用![]() 表示)。
表示)。
②已知单质硫气态时以![]() 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339![]() 、E(H-H)=436
、E(H-H)=436![]() 、E(S=S)=225
、E(S=S)=225![]() ,则
,则![]() =____________
=____________![]() 。
。
③![]() 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价,![]() 的电子式为______________。
的电子式为______________。
(2)银器长期露置在含![]() 的空气中表面会生成
的空气中表面会生成![]() 而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
(3)实验室用粗锌制取氢气时常含有少量的![]() ,可用酸性
,可用酸性![]() 溶液(
溶液(![]() 被还原为
被还原为![]() )将
)将![]() 氧化为S而除去,该反应的离子方程式为_______。
氧化为S而除去,该反应的离子方程式为_______。
(4)![]() 与
与![]() 合成硫醇
合成硫醇![]() 的反应
的反应![]() 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时![]() 的平衡转化率如图所示:
的平衡转化率如图所示:
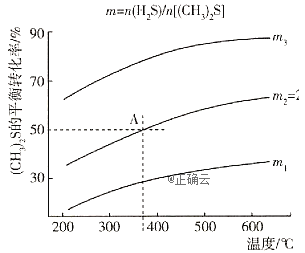
①该反应的![]() ______0(填“>”或“<");
______0(填“>”或“<");![]() _________
_________![]() (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol![]() 和0.1mol
和0.1mol![]() ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
③为提高![]() 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,在催化剂存在时反应过程中的能量变化如图所示。下列叙述正确的是
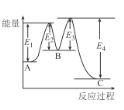
A.△H=E2-E1+E3-E4
B.加入催化剂后反应经过两步完成,其中第一步反应决定总反应速率
C.加入催化剂,△H、反应速率均发生改变
D.向密闭容器中充入3 mol H2和1molN2,发生上述反应,达到平衡时,反应放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将石灰石和硫煤混合使用,称之为“固硫”,其反应原理为:2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
2CaSO4(s)+2CO2(g) △H1=akJ·mol-1。
已知:CaO(s)+CO2(g)![]() CaCO3(s) △H2=bkJ·mol-1;
CaCO3(s) △H2=bkJ·mol-1;
2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
请回答下列问题:
(1)CaSO4(s)![]() CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
CaO(s)+SO3(g)△H=___kJ·mol-1(用a、b、c表示)。
(2)T1℃时,向某恒容密闭容器中通入一定量的CO2和足量CaO发生反应:CaO(s)+CO2(g)![]() CaCO3(s),CO2的浓度随时间变化如图所示:
CaCO3(s),CO2的浓度随时间变化如图所示:
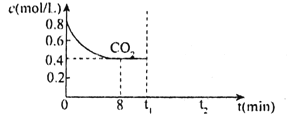
①0~8min,v(CO2)=___。
②t1min时,若保持其他条件不变,压缩容器体积至原来的![]() ,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
,t2min重新达到平衡,请在图中画出CO2的浓度自条件改变至新平衡的变化曲线___。
(3)T2℃时,向某密闭容器中通入2molSO2和1molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H3=ckJ·mol-1。
2SO3(g) △H3=ckJ·mol-1。
①若该容器为恒压密闭容器,下列选项可判断反应已达平衡状态的是___。
A.混合气体的密度不再改变
B混合气体的压强不再改变
C.相同时间内,每断裂0.1molO=O键,同时生成0.2molSO3
D.混合气体的平均相对分子质量不再改变
②若该容器为2L的恒容密闭容器,达平衡时SO3的体积分数为40%,则O2的转化率为___,T2℃时该反应的平衡常数K=___。
③反应达到②中的平衡状态后,保持反应温度和O2的浓度不变,增大容器体积,则平衡将___(填“正向”、“逆向”或“不“)移动,原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】斑蝥黄是一种有机颜料,其结构如图所示,下列说法正确的是

A.斑蝥黄的分子式为 C40H50O2
B.斑蝥黄的一氯代物可能存在 13 种结构(不考虑立体异构)
C.斑蝥黄能发生加成反应和酯化反应
D.斑蝥黄易溶于水和有机溶剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com