
【题目】下列化合物分子中,在核磁共振氢谱图中有三种吸收峰的是
A.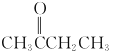 B.CH3COOCH3C.CH3OCH3D.CH3CH2CH3
B.CH3COOCH3C.CH3OCH3D.CH3CH2CH3
【答案】A
【解析】
核磁共振氢谱图中,特征峰的数目反映了有机分子中氢原子化学环境的种类,以下几种情况氢原子等效:①分子中同一个碳原子上连接的氢原子等效;②同一个碳原子上所连接的甲基.上的氢原子等效;③分子中处于镜面对称位置(相当于平面镜成像时,物与像的关系)上的氢原子是等效的;据此可分析判断。
A.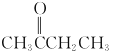 分子中有3种类型的氢原子,共有3种吸收峰,A选项满足题意;
分子中有3种类型的氢原子,共有3种吸收峰,A选项满足题意;
B.CH3COOCH3分子中有2种类型的氢原子,共有2种吸收峰,B选项不满足题意;
C.CH3OCH3分子镜面对称,两个—CH3的氢原子都等效,故只有1种类型的氢原子,只有1种吸收峰,C选项不满足题意;
D.CH3CH2CH3镜面对称,两个—CH3的氢原子都等效,有两种类型的氢原子,共有两种吸收峰,D选项不满足题意;
答案选A。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
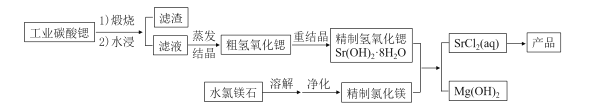
(1)锶与钙元素同主族。金属锶应保存在_______中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为__________。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是______。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为____________,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是_____。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2 除杂,写出该过程的离子方程式__________。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是______(填标号)。
A 反应器中沉淀量不再增加 B 测定不同时间反应液pH
C 测定Sr2+浓度变化 D 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)热值高、无污染,既可做燃料,又是重要的化工原料。科学家正研究利用CO2生产甲醇以发展低碳经济。
(1)已知CO(g)和CH3OH(l)的燃烧热分别为283kJmol-1和726kJmol-1。则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______。
(2)根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,则其负极反应式为______。若该燃料电池消耗1mol甲醇所能产生的最大电能为689.7kJ,与其燃烧所能释放的全部能量相比,该燃料电池的理论效率为______。
(3)探究不同条件下对合成甲醇反应的影响:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①其他条件不变,T1、T2两种温度下CH3OH的物质的量随时间的变化如图,则该反应在T1时的平衡常数比T2时的______(填“大”、“小”),处于A点的反应体系从T1变到T2,达到平衡时 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
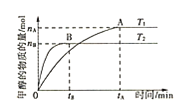
②某温度下,在体积为1L的密闭容器中加入4molCO2、8molH2,测得H2的物质的量随时间变化如图曲线(甲)所示:

则a→b时间段内v(CH3OH)=______molL-1min-1;若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______(填序号)。
A.加催化剂 B.增大压强 C.升高温度 D.增大CO2浓度
若图中曲线甲平衡后保持恒温恒容,按如表各组的物质的量再次增加投入反应混合物,其中平衡向正反应方向进行的是______。
物质 | n(CO2) | n(H2) | n(CH3OH) | n(H2O) |
A | 0 | 0 | 1 | 1 |
B | 1 | 0 | 1 | 0 |
C | 0 | 1 | 1 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丁烷是无色透明液体,可用作制药、染料、功能性色素、香料等的原料,也可作半导体中间原料。其实验窒制备原理及流程如图:
KBr+H2SO4![]() HBr+KHSO4
HBr+KHSO4
C4H9OH+HBr![]() C4H9Br+H2O
C4H9Br+H2O

可能用到的有关数据及信息如下表:
名称 | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | 浓硫酸中溶解性 |
正丁醇 | 74 | 117.7 | 0.8098 | 微溶 | 能溶 |
1-溴丁烷 | 137 | 101.6 | 1.266 | 微溶 | 不溶 |
正丁醚 | 130 | 142 | 0.7689 | 不溶 | 反应成盐 |
回答下列问题:
(1)操作Ⅰ是用如图所示实验装置,加热仪器A中的反应物制备1-溴丁烷(加热和夹持装置均略去)。

①仪器B的作用是_________。
②若浓硫酸太浓或加热A时温度过高,均会产生大量红棕色气体,原因是________(用化学方程式表示);该制备反应中产生的有机副产物除正丁醚外,还可能有_______(填结构简式)。
③图中装置有一处错误,请提出改进建议:__________。
(2)操作Ⅱ是用如图所示实验装置蒸出1-溴丁烷粗产品(加热和夹持装置均略去)。

①仪器D的名称是_______。
②判断1-溴丁烷是否蒸完的方法是_______。
(3)操作Ⅲ是将产品转移至分液漏斗中,依次经过水、浓硫酸、水、10mL 10%碳酸钠溶液、水五次洗涤并分液,目的是除去1-溴丁烷粗产品的各种杂质。
①浓硫酸的主要作用是_______。
②用10mL 10%碳酸钠溶液洗涤时必须的操作是_______。
(4)操作N将产品用无水CaCl2干燥后再蒸馏纯化。1-溴丁烷的产率为____ (近似取整)%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
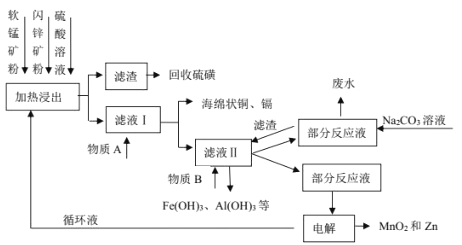
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇主要来源于花生、桑葚等植物中,是肿瘤的化学预防剂,其结构简式如图所示。下列有关白藜芦醇的说法中错误的是

A.分子式为C14H12O3
B.属于酚类化合物
C.分子中的所有原子一定共平面
D.1mo1该有机物最多可与7mo1H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.128 g HI加热充分分解生成氢气的分子数为0.5NA
B.15 g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA
C.标准状况下,1.12 L氖气与1.12 L甲烷所含质子总数均为0.5NA
D.0.2mol![]() 与0.5mol
与0.5mol![]() 在光照下充分反应,产物中C—Cl键总数为0.5NA
在光照下充分反应,产物中C—Cl键总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硝酸氧化C2H2制取H2C2O4·2H2O的装置如图所示(电石主要成分为CaC2,含少量CaS杂质),下列说法正确的是( )
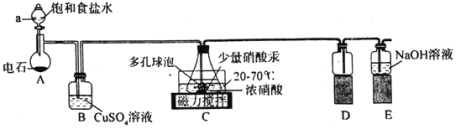
A.装置A可作MnO2和浓盐酸反应制备Cl2的发生装置
B.装置B的作用是除去C2H2中的H2S
C.装置D的作用是收集草酸
D.装置E中发生反应的离子方程式为3NO2+2OH-=2NO3-+NO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是 PH3(膦),其结构式为 __________ ,下列有关 PH3 的说法错误的是___________ 。
a.PH3 分子是极性分子
b.PH3 分子稳定性低于 NH3 分子,因为 N-H 键键能高
c.一个 PH3 分子中,P 原子核外有一对孤电子对
d.PH3 沸点低于 NH3 沸点,因为 P-H 键键能低
(2)PH3 的沸点比 NH3______填“高”或“低”) NH3 的水溶液碱性_____PH3 的水溶液碱性(填“大于”或“小于”);氯化鏻(PH4C1)与碱反应生成膦的离子方程式为 _______________________ 。
(3)PH3 是一种还原剂,其还原能力比 NH3 强,通常情况下能从Cu2+、Ag+、Hg2+等盐溶液中还原出金属, 而本身被氧化为最高氧化态。PH3 与 CuSO4 溶液反应的化学方程式为 ______________。
(4)“荧光”产生的原理是Ca3P2 在潮湿的空气中剧烈反应,写出该反应的化学方程式__________________。
(5)PH3 有毒,白磷工厂常用 Cu2+、Pd2+液相脱除 PH3:PH3+2O2![]() H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时, 溶解在溶液中O2 的体积分数与 PH3 的净化效率与时间的关系如图所示,回答下列问题:
①由图可知,富氧有利于______(选填“延长”或“缩短”)催化作用的持续时间。
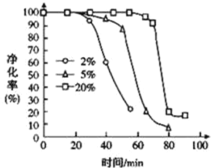
②随着反应进行,PH3 的净化效率急剧降低的原因可能为 _________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com