
要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好是
A.碳酸盐 B.硫酸盐 C.硫化物 D.以上沉淀剂均可
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
根据下列热化学方程式,判断氢化物的稳定性顺序正确的是
N2(g)+3H2 (g)=2NH3(g) ΔH=-92.38 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-184.72 kJ·mol-1
I2(g)+H2(g)=2HI(g) ΔH=+51.92 kJ·mol-1
A.HI>HCl>NH3 B.HCl>NH3>HI
C.HCl>HI>NH3 D.NH3>HI>HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下列物质的存贮方法错误的是
A.金属钠保存在石蜡油或煤油中
B.用铁制或铝制容器运输浓硫酸、浓硝酸
C.FeCl2溶液的试剂瓶中要放铁钉
D.氢氧化钠溶液盛装在玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
将含有0.4molCuSO4和0.2molNaCl水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3molCu,另一电极上析出气体在标况下的体积为
A.4.48L B.5.6L C.6.72L D.13.44L
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=+57.4 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石一定比石墨稳定
C.已知2H2O(g)=2H2(g)+O2(g) △H=+483.6 kJ·mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解
D.已知C(s)+O2(g)=CO2(g) △H=a kJ·mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) △H=(2a﹣b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:实验题
(18分)化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
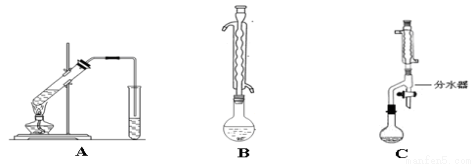
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是_________________________;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 ________________________。
Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式_______________________。甲同学的实验应该在___________中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是________________(用化学方程式表示),所以他认为应该检验_____________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_________。
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸。③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用_________(结合方程式与文字表述)。
(5)C装置中出现的现象是_________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 ________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
下列关于元素及其化合物的说法,正确的是
A.Fe在常温下可与浓硝酸,浓硫酸,稀硝酸发生剧烈反应
B.碳酸氢钠可用于制备纯碱,治疗胃酸过多的药物,食品发酵剂
C.通过丁达尔效应可以鉴别稀豆浆和氢氧化铁胶体
D.根据某元素的质子数和中子数,可以确定该元素的相对原子质量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2 N2O5 (g) 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表

下列说法中不正确的是
A.T1温度下,500s时O2的浓度为0.74mol·L-1
B.平衡后其他条件不变。将容器的体积压缩到原来的l/2,则再平衡时c(N2O5)> 5.00mol·L-1
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2则K1<K2
D.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com