
(18分)化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
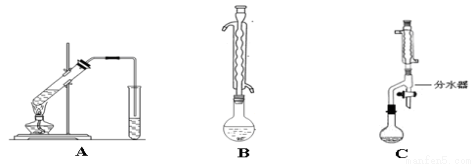
Ⅰ.下图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为下图B装置进行酯化反应效果比A要好,他的理由是_________________________;
某同学乙经查阅资料认为下图C装置进行酯化反应效果更好,他的理由是 ________________________。
Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)碳与浓硝酸反应的方程式_______________________。甲同学的实验应该在___________中进行,才符合化学实验安全性的要求。
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是________________(用化学方程式表示),所以他认为应该检验_____________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_________。
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸。③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用_________(结合方程式与文字表述)。
(5)C装置中出现的现象是_________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 ________________。
科目:高中化学 来源:2014-2015河北邢台一中高一3月月考化学试卷(解析版) 题型:选择题
“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是

A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:填空题
(14分)现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是_____(填序号,下同),水的电离程度相同的是______。
(2)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(3)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c (Na+) > c( CN-),用“>、<、=”符号填空
①溶液中c (OH-) c (H+)
②c (HCN) c (CN-)
(4)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。

①B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确?
(填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
②在C点,溶液中离子浓度由大到小的顺序为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好是
A.碳酸盐 B.硫酸盐 C.硫化物 D.以上沉淀剂均可
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
纳米钴(Co)是加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三联考一化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)= mol·L-1
mol·L-1
B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:填空题
(14分)四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。

请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H=-19.5KJ/mol ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.用饱和硫酸铵溶液沉淀蛋白质
B.用生石灰干燥氨气
C.用铝制的容器盛装浓硫酸
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三下学期一模考试理综化学试卷(解析版) 题型:填空题
(17分)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=a kJ·mol-1
2SO3(g) △H=a kJ·mol-1
在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:

上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com