
| HX | HY | HZ | |
| 浓度mol?L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石、C60都有较大的硬度和较高的熔点 |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、Cl2、SO2都可以使品红溶液褪色 |
| D、镁、铁等金属在一定条件下与水反应都生成对应的氢氧化物和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向甲容器中充入一定量的氦气 |
| B、向乙容器中充入一定量的N2 |
| C、升高乙容器的温度 |
| D、增大甲容器的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
| B、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)>c(HRO3-)+c(RO32-) |
| C、常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| D、常温下,将0.1mol?L-1NH4Cl溶液与0.05mol?L-1NaOH溶液等体积混合:c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
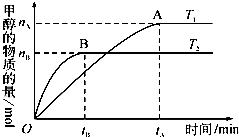 以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )
以CO2与H2为原料还可合成液体燃料甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.现将1mol CO2和3mol H2充入容积为2L的密闭容器中发生上述反应,下列说法正确的是( )| A、若保持恒温,当容器中n(CH3OH):n(H2O)为1:1时,该反应已达平衡状态 |
| B、若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态 |
| C、若其他条件不变,实验结果如图所示,则平衡常数:K(T1)<K(T2) |
| D、保持温度不变,当反应已达平衡时,若向容器中再充入1 mol CO2和3 mol H2,当达到新平衡时,n(CH3OH):n(H2)将升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-F | C-Cl | C-I | H-H | S=S | H-S |
| 键能 | 427 | 330 | 218 | 436 | 255 | 339 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com