
【题目】下列说法正确的是( )
A. 乙醇属于烃类化合物B. 苯能发生取代反应
C. 乙酸能发生银镜反应D. 纤维素遇碘水变蓝
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1) 根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):_______________。

(2) 装置④的作用:______________________。装置⑤的作用为_________________________________。
(3) 如果实验时,称取wg样品和过量盐酸反应后,设收集到氧气的体积(标准状况)为VmL,则此样品的纯度为______________。(列出计算式,不需化简)
(4) 某次实验,称取1.22g样品进行测定,实验室有50mL,100mL,150mL三种规格的量筒,应选用规格为_______的量筒进行实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证实氢氧化钡溶液和硫酸溶液的反应是离子反应,实验设计和过程如下:如图所示连接好装置,向烧杯中加入25 mL 1 mol·L-1的氢氧化钡溶液和2滴酚酞溶液,再一边不断地滴加1 mol·L-1的硫酸溶液,并轻轻振荡。试完成下列内容:

(1)实验现象及①溶液颜色变化为______,原因是________。
②灯泡亮度变化:__________,原因是_______。
③溶液变浑浊,原因是___________。
(2)实验结论:稀硫酸与氢氧化钡溶液反应的实质是_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池用溴化锌溶液作电解液,并在电池间不断循环。下列有关说法正确的是
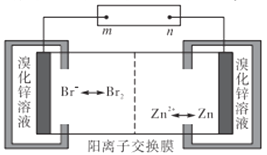
A. 充电时n接电源的负极,Zn2+通过阳离子交换膜由左侧流向右侧
B. 放电时每转移1mol电子负极区溶液质量减少65g
C. 充电时阴极的电极反应式为Br2+2e-=2Br-
D. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法不正确的是 ( )

A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③12,④12
D.空间利用率的大小关系为:①<②<③=④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.己知某些化学键的键能数据如下:
化学键 | C=O | C-O | C-H | H-H | O-H |
键能/kJ·mol-1 | a | b | c | d | e |
(1)CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
CH3OH(g)+H2O(g) △H=____kJ/mol(用字母表示)。
II.将燃煤废气中的CO 转化为二甲醚的反应原理为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如下图所示:

①该反应的△H_____0(填“>”或“<”)。
②700K,将4molH2和2molCO2投入2L恒容密闭容器中,反应经3min达到平衡,则CH3OCH3(g)在0~3min内的生成速率为_________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是_______。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0molCO26.0molH2 | 0.10mol | 0.04mol | 0.02mol |
II.1.0molCH3OCH33.0molH2O | X1 | Y1 | Z1 |
①P3______P2(填“>”、“<”或“”);
②P2下,I中CH3OCH3的平衡转化率为_______。
III.在一定条件下,CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(5)在1L密闭容器中若CO2(g)、H2(g)初始投料均为1mol,反应达平衡时CO在平衡混合气中的体积分数为25%,则该温度下该反应的平衡常数K=____。向此容器中再充入CO2(g)、H2(g)各0.5mol,则平衡_______(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com