
【题目】实验室里将NaClO3和Na2SO3按质量之比为71∶42倒入烧瓶中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油(液态烷烃混合物)的分解产物,设计了如下实验方案。下列说法错误的是

A. 石蜡油分解产物中含有烯烃,不含烷烃
B. 试管乙、丙中溶液均褪色,分别发生氧化反应、加成反应
C. 碎瓷片有催化和积蓄热量的作用
D. 结束反应时,为防止倒吸,先撤出导管,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。
请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为________。
(2)X、Y、Z三种元素第一电离能从大到小顺序为______________________。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):

①该分子中两个Y原子之间的键型组合正确的是________。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | |||||||
(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。
试写出:
(1)a粒子的原子结构示意图是________;b粒子的电子排布式为________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,d分子的空间构型为________,键角为________;若d为正四面体形分子,其电子式为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定浓度均为0.10mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示。下列判断不正确的是
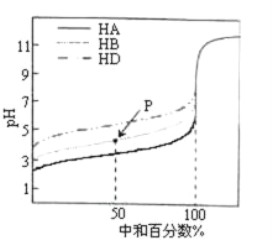
A. 三种酸的电离平衡常数:K(HA)>K(HB)>K(HD)
B. 滴定至M点时,溶液中:c(B-)>c(Na+)>c(HB)>cH+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达到100%时,三种溶液中:c(HA)>c(HB)>c(HD)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置(甲、乙、丙三池中的溶质均足量)研究有关电化学的问题,当闭合该装置的开关K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_______ (填“原电池”“电解池”或“电镀池”), A电极的电极反应式为_____.
(2)丙池中F电极为______(填“正极”“负极”“阴极”或“阳极”),该池中发生总反应的化学方程式为________
(3)若丙池中两端的电极不变,将其溶液换成NaCl溶液,则开关闭合一段时间后,丙池中溶液的PH将____(填“增大”“减小”或“不变”)。
(4)当乙池中C极质量减轻4.32 g时,甲池中B电极理论上消耗O2 的体积为____mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图甲所示为二维平面晶体示意图,化学式表示为AX3的是________。
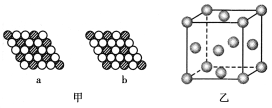
(2)图乙为一个金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________个;
②该晶胞称为________(填序号);
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用aρ表示)。
(3)《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如下图所示。下列有关说法正确的是________。
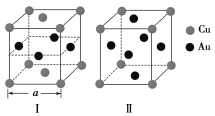
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为a cm,则图Ⅰ中合金的密度为![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有2molSO2的恒容容器中通入过量氧气发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,下列说法中正确的是
2SO3(g) ΔH<0,下列说法中正确的是
A. 氧气过量,所以充分反应后可生成2molSO3
B. 反应达平衡的过程中,混合气体的平均相对分子质量不断减小
C. 反应达平衡后,升高温度,SO2的转化率减小
D. 反应达平衡后,增大SO2的浓度,平衡右移,故SO2的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com