
【题目】某市的“二期课改”中,初中化学引入“物质的量”的教学内容。物质的量是一种新的物理量,其单位是摩尔(mol),1摩尔物质大约含有6.02×1023个该物质的微粒.如1mol氢气含有6.02×1023个H2分子,含有2×6.02×1023个H原子。据此回答:
(1)物质的量与物质的质量、物质的数量是___(填“相同”或“不同”)的物理量。
(2)1mol硝酸中含有___个H原子,含有___个N原子。
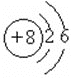
(3)如图是氧原子的结构示意图,那么,1mol氧气分子中含有___个电子。
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 某外围电子排布为4d15s2基态原子,该元素位于周期表中第五周期第ⅢB族
B. 在元素周期表中,s区,d区和ds区的元素都是金属元素
C. 当碳原子的核外电子排布由![]() 转变为
转变为![]() 时,释放能量,由激发态转化成基态
时,释放能量,由激发态转化成基态
D. 非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:______________________。当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是______________________。
(4)写出用N2H4制备Cu2O的化学方程式:______________________,操作X包括___________、洗涤、烘干,其中烘干时要隔绝空气,其目的是___________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的最高化合价与最低化合价代数和为2 ,下列说法不正确的是( )
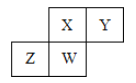
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:
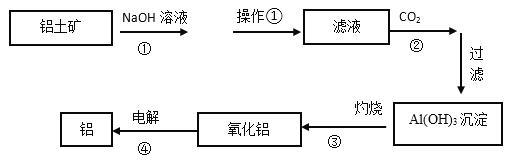
(1)操作①的名称是:_________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①的离子方程式___________________________;④的化学反应方程式___________。
(3)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。下列说法中不正确的是
A. H2NCONH2与H2O2是通过氢键结合的B. H2O2分子中只含σ键,不含π键
C. H2NCONH2中σ键与π键的数目之比为7:1D. H2NCONH2·H2O2属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为____。元素Mn与O中,电负性较大的是___,基态原子核外未成对电子数较多的是____。
(2)CO2和CH3OH分子中C原子的杂化形式分别为____和____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
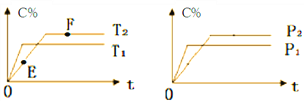
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_______________________。
(2)砷与氢元素可形成化合物砷化氢,该化合物的空间构型为_____________,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式________。
(4)已知由元素砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中砷原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式____________;
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定铝原子在三维空间中堆积方式________________(已知NA=6.02×1023,1pm=10-10cm,4053=6.64×107);晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______pm.(只列出计算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com