
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为____。元素Mn与O中,电负性较大的是___,基态原子核外未成对电子数较多的是____。
(2)CO2和CH3OH分子中C原子的杂化形式分别为____和____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 O Mn sp sp3 H2O>CH3OH>CO2>H2 离子键和π键![]()
【解析】
(1)Co的核电荷数为27,基态原子核外电子排布式:1s22s22p63s23p63d74s2或[Ar]3d74s2;O元素是非金属元素而Mn是过渡金属元素,因此第一电离能较大的是O;O基态原子价电子排布式为2s22p4,所以其核外未成对电子数为2,Mn基态原子价电子排布式为3d54s2,所以其核外未成对电子数为5,因此Mn与O基态原子核外未成对电子数较多的是Mn;综上所述,本题答案是:1s22s22p63s23p63d74s2或[Ar]3d74s2 O Mn;
(2)CO2的分子构型为直线型,C的价层电子对数为2,中心碳原子为sp杂化,CH3OH中心碳原子形成4个σ键,C上没有孤电子对,C为 sp3杂化;综上所述,本题答案是:sp,sp3;
(3)CO2低压合成甲醇反应中所涉及的4种物质中,水和甲醇均为极性分子,分子间有氢键,且水分子形成的氢键较多,沸点最高;CO2与H2均为非极性分子, CO2相对分子质量较大,分子间作用力较大,沸点高于H2,因此沸点从高到低的顺序为: H2O>CH3OH>CO2>H2;
(4)硝酸根离子中含有σ键和π键,且硝酸锰为离子化合物,离子化合物中一定含有离子键;综上所述,本题答案是:离子键和π键。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】(1)写出SO3分子的空间构型是____;是____分子(填“极性”或“非极性”);常见的等电子体的化学式:一价阴离子______ (写出一种),它们的中心原子采用的杂化方式都是_______。
(2)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为__,甲醇分子内的O—C—H键角___(填“>”“<”或“=”)甲醛分子内的O—C—H键角,甲醇极易溶于水,其主要原因是_____。
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____(填“>”“<”或“=”)HIO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)检验铁离子(Fe3+):试剂____________(填化学式);现象______________。有铁离子(Fe3+)的环境下检验是否含有亚铁离子(Fe2+):试剂:_________(填化学式),现象_______________。
(2)用小苏打片治疗胃酸过多的离子方程式为____________。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是_____________。(用化学方程式表示).
(4)除去混入Fe2O3粉末中少量Al2O3杂质离子方程式为______________。
(5)将AlCl3溶液蒸干,灼烧,得到的固体产物是__________。AlCl3溶液和NaHCO3溶液混合时发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市的“二期课改”中,初中化学引入“物质的量”的教学内容。物质的量是一种新的物理量,其单位是摩尔(mol),1摩尔物质大约含有6.02×1023个该物质的微粒.如1mol氢气含有6.02×1023个H2分子,含有2×6.02×1023个H原子。据此回答:
(1)物质的量与物质的质量、物质的数量是___(填“相同”或“不同”)的物理量。
(2)1mol硝酸中含有___个H原子,含有___个N原子。
(3)如图是氧原子的结构示意图,那么,1mol氧气分子中含有___个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积固定的容器中,反应aA(g)+bB(g)![]() hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少D.amol/L<c(A)<2amol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近
B. 邻二甲苯和液溴在光照下取代产物可能为
C. 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂中的操作
D. 常用质谱法进行有机物相对分子质量的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH![]() CH2 + HBr
CH2 + HBr![]() CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后得到8molCO2和4molH2O。烃A在不同条件下能发生如下图所示的一系列变化。
CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后得到8molCO2和4molH2O。烃A在不同条件下能发生如下图所示的一系列变化。
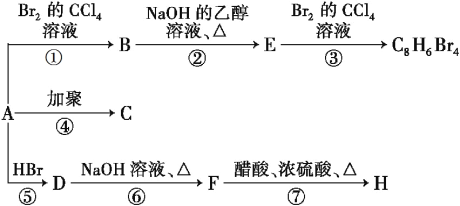
(1)A的结构简式:_______。
(2)上述反应②是_______反应,⑦是_______反应。(填反应类型)
(3)写出C、H物质的结构简式:C_________,H_________。
(4)写出D![]() F反应的化学方程式_______________。
F反应的化学方程式_______________。
(5)化合物G是F的同分异构体,遇FeCl3溶液显紫色,且苯环上只有两种不同化学环境的氢原子,写出符合条件的G的结构简式__________。(任写一种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
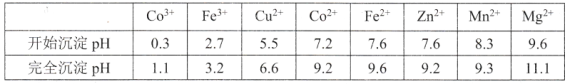
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3的作用是_________,相关的离子方程式为__________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为__________________(写化学式)。滤液3经过多次萃取与反萃取制备CoCl2晶体
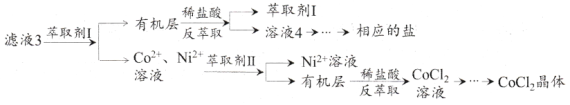
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是___________________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①铅蓄电池总反应为: Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列关于电池的叙述正确的是
A.充电电池的化学反应原理是氧化还原反应
B.铅蓄电池可以无限制地反复放电、充电,不会造成环境污染
C.铅蓄电池比锂电池的理论比能量高
D.铅蓄电池正极电极反应为:PbO2 +4H+ +2e— = Pb2+ +2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com