
【题目】已知:CH3—CH![]() CH2 + HBr
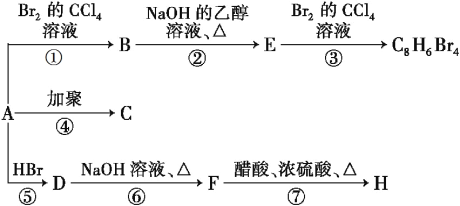
CH2 + HBr![]() CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后得到8molCO2和4molH2O。烃A在不同条件下能发生如下图所示的一系列变化。
CH3—CHBr—CH3(主要产物)。1 mol某烃A充分燃烧后得到8molCO2和4molH2O。烃A在不同条件下能发生如下图所示的一系列变化。
(1)A的结构简式:_______。
(2)上述反应②是_______反应,⑦是_______反应。(填反应类型)
(3)写出C、H物质的结构简式:C_________,H_________。
(4)写出D![]() F反应的化学方程式_______________。
F反应的化学方程式_______________。
(5)化合物G是F的同分异构体,遇FeCl3溶液显紫色,且苯环上只有两种不同化学环境的氢原子,写出符合条件的G的结构简式__________。(任写一种即可)
【答案】![]() 消去 酯化(或取代)
消去 酯化(或取代) 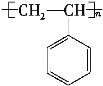
 +NaOH
+NaOH![]()
 +NaBr
+NaBr 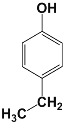 或
或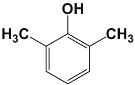 或
或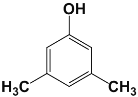
【解析】
1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8。由于不饱和度太大,猜测分子中含有苯环,且A可以发生加聚反应生成C,故A中含有碳碳双键,则A的结构简式是![]() ,C的结构简式是
,C的结构简式是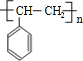 。A与溴发生加成反应生成B,所以B的结构简式是
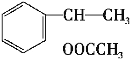
。A与溴发生加成反应生成B,所以B的结构简式是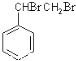 。B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,所以E的结构简式为
。B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,所以E的结构简式为![]() 。E与单质溴发生加成反应生成
。E与单质溴发生加成反应生成![]() 。
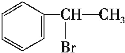
。![]() 与HBr发生加成反应生成D,D的结构简式为
与HBr发生加成反应生成D,D的结构简式为![]() (主要产物)。
(主要产物)。![]() 在氢氧化钠水溶液、加热条件下发生水解反应生成F,F的结构简式为
在氢氧化钠水溶液、加热条件下发生水解反应生成F,F的结构简式为![]() 。
。![]() 与乙酸发生酯化反应生成H,H的结构简式为
与乙酸发生酯化反应生成H,H的结构简式为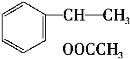 。
。
(1)由上述分析可知,A的化学式为C8H8,结构简式为![]() ;
;
答案:![]()
(2)上述反应中,反应②B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,所以E的结构简式为![]() ;反应⑦是
;反应⑦是![]() 与乙酸发生酯化反应生成H,H的结构简式为
与乙酸发生酯化反应生成H,H的结构简式为![]() ;
;
答案: 消去 酯化(或取代)
(3)由上述分析可知,C为 ,H为
,H为 ;
;
答案: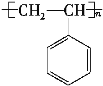

(4)D→F是![]() 在氢氧化钠水溶液、加热条件下发生水解反应生成
在氢氧化钠水溶液、加热条件下发生水解反应生成![]() ,反应方程式为
,反应方程式为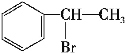 +NaOH
+NaOH![]()
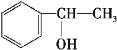 +NaBr ;
+NaBr ;
答案: +NaOH
+NaOH![]()
 +NaBr
+NaBr
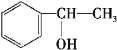
(5)化合物G是F(![]() )的同分异构体,遇FeCl3溶液显紫色,说明有酚羟基,且苯环上只有两种不同化学环境的氢原子,说明结构非常对称,符合条件的G的结构简式:
)的同分异构体,遇FeCl3溶液显紫色,说明有酚羟基,且苯环上只有两种不同化学环境的氢原子,说明结构非常对称,符合条件的G的结构简式: 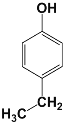 或
或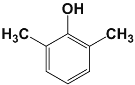 或
或 ;
;
答案:  或
或 或
或


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】今有化合物:
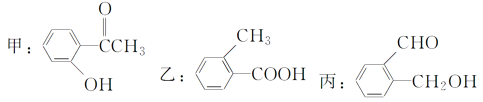
(1)请写出丙中含氧官能团的名称:___________、__________。
(2)请判别上述哪些化合物互为同分异构体:____、______、_____。(用“甲,乙,丙”表示)
(3)请分别写出鉴别甲、乙、丙三种化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:试剂________________现象________________________;
鉴别乙的方法:试剂________________现象________________________;
鉴别丙的方法:试剂________________现象________________________。
(4)请按酸性由强至弱的顺序排列甲、乙、丙的顺序:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:
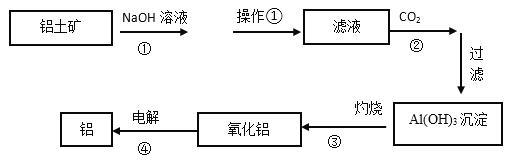
(1)操作①的名称是:_________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①的离子方程式___________________________;④的化学反应方程式___________。
(3)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为____。元素Mn与O中,电负性较大的是___,基态原子核外未成对电子数较多的是____。
(2)CO2和CH3OH分子中C原子的杂化形式分别为____和____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
汽车彻底改变了我们生活,成为我们的不可或缺的交通工具之一。汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放,在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
【1】上述催化器中发生的反应属于
A.复分解反应B.分解反应C.置换反应D.不属于四种基本反应
【2】关于反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)中,下列说法正确的是
2CO2(g)+N2(g)中,下列说法正确的是
A.CO作氧化剂B.CO发生氧化反应
C.NO被氧化D.NO作还原剂
【3】已知汽车尾气处理反应能量过程如下图,下列说法正确的是

A.该反应为放热反应
B.该反应为吸热反应
C.形成N≡N化学键需要吸收热量
D.反应物的总能量小于生成物的总能量
【4】下列反应条件的改变对该反应速率的影响正确的是
A.升高温度能减慢反应速率
B.增大反应物浓度能减缓反应速率
C.达到平衡时,CO能100%转化为CO2
D.使用催化剂能加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
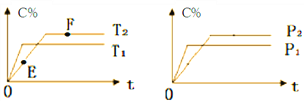
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF酸的电离方程式可以表示为:HF+H2O![]() H3O++F—
H3O++F—
B. 加入铝粉可以释放出氢气的溶液中一定可以存在Na+、Cl—、NH4+、NO3—四种离子。
C. 由水电离出来的c(H+)=1×10—13mol·L—1的溶液中一定能存在CO32—、K+。
D. 向硫代硫酸钠中滴加稀硫酸的方程式为:3S2O32- + 2H+=4S↓+2SO42—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
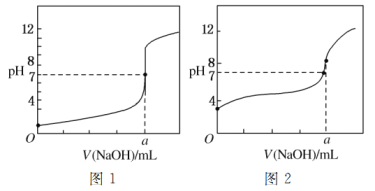
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
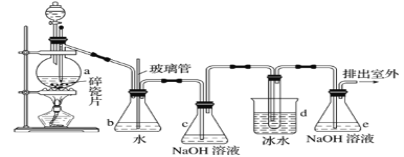
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列作中必需的是________________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com