
【题目】明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如图所示:
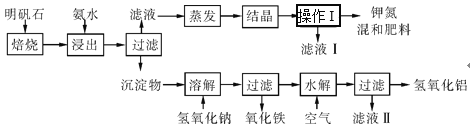
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。实验需要500mL稀氨水(每升含有19.60g氨)需要取浓氨水(每升含有250.28g氨)___mL,用规格为___mL量筒量取。
(2)写出沉淀物中所有物质的化学式:___。
(3)操作Ⅰ的名称是___,所用的玻璃仪器有___。
(4)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量(以K2O计),完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量BaCl2溶液,产生___。
②___、___、___(依次填写实验操作名称)。
③冷却、称重。
④若试样为mg,沉淀的物质的量为nmol,则试样中钾的含量(以K2O计)为___%(质量分数)(用含m、n的代数式表示)。
【答案】39.2 50 Al(OH)3、Al2O3、Fe2O3 过滤 漏斗、烧杯、玻璃棒 白色沉淀 过滤 洗涤 干燥 ![]()
【解析】
明矾焙烧,再加氨水,铝离子转化为氢氧化铝沉淀,过滤,滤液为硫酸铵和硫酸钾,滤渣为氢氧化铝、还含有氧化铝和少量氧化铁,滤渣中加氢氧化钠,铝的化合物转化为偏铝酸钠,氧化铁不溶解,过滤,滤液中通入空气,促进偏铝酸钠的水解生成氢氧化铝;含有硫酸铵和硫酸钾的溶液通过蒸发结晶、过滤,得到硫酸铵和硫酸钾晶体混合物,滤液中含有少量的硫酸铵和硫酸钾。
(1)配制500mL稀氨水(每升含有19.60g氨),需要使用500mL容量瓶,需要浓氨水(每升含有250.28g氨)的体积为![]() ≈0.0392L=39.2mL,所以要用50mL的量筒;
≈0.0392L=39.2mL,所以要用50mL的量筒;
(2)根据分析可知沉淀物为Al(OH)3、Al2O3、Fe2O3;
(3)操作Ⅰ之后得到滤液和滤渣,过操作Ⅰ为过滤;过滤所需要的玻璃仪器有:漏斗、烧杯、玻璃棒;
(4)①混合肥料中含有K2SO4、(NH4)2SO4,加入足量氯化钡会生成硫酸钡白色沉淀;
②本实验中需要确定生成的硫酸钡沉淀的量,从而计算出K的含量,所以要先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重;
④设混合物中K2SO4的物质的量为x mol,(NH4)2SO4的物质的量为y mol,根据元素守恒有![]() ,解方程组可得x=
,解方程组可得x=![]() ,所以则试样中钾的含量(以K2O计)为
,所以则试样中钾的含量(以K2O计)为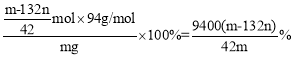 。
。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列六种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2,按照不同的分类标准,它们中有一种物质与其他五种有明显的不同,请找出这种物质,并写出分类的依据(至少要写出两种分类方法)。
①________________________________________________________________________;
②________________________________________________________________________。
(2)从反应中有无离子参加,可以将化学反应分为离子反应和非离子反应。Na2O2与水反应的离子方程式是________。从反应中________,可以将化学反应分为氧化还原反应和非氧化还原反应,从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:________________________________________________________________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.1mol/L和0.4mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L
B.所得溶液中c(H+)=0.5mol/L
C.所得气体在标准状况下的体积为0.448L
D.反应中转移0.06mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g)+ H2O(g)![]() C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
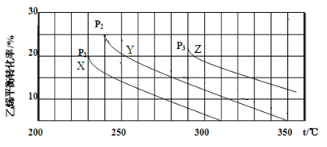
A. Y对应的乙醇的质量分数为1/9
B. X、Y、Z对应的反应速率:υ(X) > υ(Y) > υ(Z)
C. X、Y、Z对应的平衡常数数值:KX > KY > KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
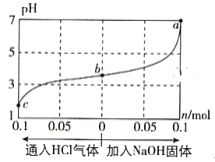
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com