
【题目】氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄露需要及时处理。
(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,则向NaCN溶液中通入少量CO2,发生反应的离子方程式是________。
(2)若氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式 _____________;
②已知:氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3=NaSCN+Na2SO3,当1.96gNaCN完全反应时转移的电子物质的量是__________;实验室中硫氰化钠可以代替硫氰化钾检验______________。
(3)现要检测某经过处理过的废水中氰化钠的含量。已知:废水中氰化钠最高排放标准是0.50mg/L;Ag++2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓,CN—优先与Ag+反应。
实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;用1.00×10—4mol·L—1的标准AgNO3溶液滴定,达到滴定终点时,消耗AgNO3溶液的体积为1.50mL。(假设废水中没有其它成分参与反应。)
①滴定达到终点时的现象是____________________________________;
②该废水________(填“能”或“不能”)直接排放到河流中,通过计算结果说明得出上述结论的依据:____________________。
【答案】 CN—+CO2+H2O=HCO3—+HCN CN—+H2O2+H2O=HCO3—+NH3↑ 0.16mol 检验Fe3+ 当滴入一滴AgNO3溶液时有黄色沉淀生成,并30s不溶解 能 通过计算得知该废水中氰化钠的含量为0.49mg/L,符合排放标准
【解析】(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,根据强酸制弱酸的原则,应该得到HCN,但是![]() 不能制得HCN,所以生成碳酸氢钠,反应的方程式为:
不能制得HCN,所以生成碳酸氢钠,反应的方程式为:![]() 。离子方程式为CN—+CO2+H2O=HCO3—+HCN。
。离子方程式为CN—+CO2+H2O=HCO3—+HCN。
(2)①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体可能是氨气,所以该反应的离子方程式CN—+H2O2+H2O=HCO3—+NH3↑
②已知 NaCN+Na2S2O3=NaSCN+Na2SO3 转移电子为,
1mol 4mol
1.96g/49g.com-1 X X=0.16mol
因为硫氰化钠和硫氰化钾都含有硫氰离子,硫氰离子与铁离子反应,得到红色硫氰化铁来检验铁离子。答案: Fe3+。
(3)①滴定达到终点时的现象是; 当滴入一滴AgNO3溶液时有黄色沉淀生成,并30s不溶解,说明达到滴定终点。答案:当滴入一滴AgNO3溶液时有黄色沉淀生成,并30s不溶解。
②由 Ag+ + 2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓
1mol 2mol
0.0015L![]() 1.00×10—4mol·L— X X=3
1.00×10—4mol·L— X X=3![]() 10—7mol
10—7mol
(3![]() 10—7mol
10—7mol![]() 49g.mol)/3
49g.mol)/3![]() 10-2L =0.49mg/L<0.50mg/L达到了排放标准,故可以排放。答案:能 0.49mg/L
10-2L =0.49mg/L<0.50mg/L达到了排放标准,故可以排放。答案:能 0.49mg/L


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在含有1mol HNO3和2molH2SO4的混合稀溶液中,加入1.5molCu,加热充分反应,产生的气体在标准状况下的体积约为( )
A.5.6L
B.11.2L
C.22.4L
D.44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 molL-1 Na2CO3溶液与0.1 molL-1盐酸等体积混合,下列关系正确的是
A. c ( Na+ )> c(![]() ) > c(H+) > c(
) > c(H+) > c(![]() )> c(OH-)
)> c(OH-)
B. c( Na+ )+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
C. c( Na+ )=c(![]() )+2C(
)+2C(![]() )+c(H2CO3)
)+c(H2CO3)
D. c(OH-)+c(![]() )=c(H2CO3)+c(H+)
)=c(H2CO3)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池是一种新型的二次电池,由于具有较高的比能量而成为未来电动汽车的希望。其放电时的工作原理如图所示。下列说法正确的是
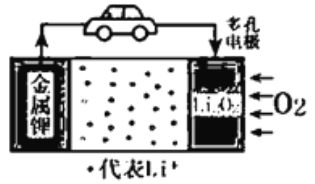
A. 该电池放电时,锂电极发生了还原反应
B. 放电时,Li+向锂电极迁移
C. 电池中的电解液可以是有机电解液或稀盐酸等
D. 充电时,电池正极的反应式为Li2O2-2e-=2Li++O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
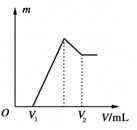
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关知识回答下列问题
(1)25℃时,0.1 molL-1的一元酸HA溶液中c(H+)=1.0×10-4 molL-1,请回答下列问题:此时溶液的pH=_______,HA是________酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,pH最小是_________。
(3)向50ml 0.018molL-1的AgNO3溶液中加入50m1 0.020molL-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__molL-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 molL-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是__________。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可以鉴别它们,这种试剂是( )
A.盐酸
B.NaOH溶液
C.氨水
D.KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com