
常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是
A.加入适量的NaCl,可使c(NH4+) = c(Cl-)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸, 的值减小
的值减小
D.1.0 mol·L-1的NH4Cl溶液中c(NH4+)比该混合溶液大
A
【解析】
试题分析:A、等浓度的氨水与氯化铵的混合液呈碱性,c(H+)< c(OH-),根据电荷守恒,则c(NH4+) > c(Cl-),加入氯化钠后氯离子浓度增大,而铵根离子浓度不变,可使c(NH4+) = c(Cl-),正确;B、该混合液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度,滴加几滴浓氨水,溶液的碱性增强,尽管浓氨水中一水合氨的电离度小,但铵根离子的浓度、氢氧根离子浓度仍大于原溶液中的铵根离子浓度、氢氧根离子浓度,溶液的碱性增强,所以c(NH4+)增大,错误;C、滴加几滴浓盐酸,溶液的pH减小,氢氧根离子浓度减小,则一水合氨的电离正向移动,铵根离子浓度增大,一水合氨的浓度减小,比值增大,错误;D、因为该混合液中一水合氨的电离程度大于铵根离子的水解程度,则铵根离子浓度会大于1.0mol/L,而1.0 mol·L-1的NH4Cl溶液中c(NH4+)会因为铵根离子的水解小于1.0mol/L,错误,答案选A。
考点:考查弱电解质的电离平衡的判断,离子浓度的变化判断
考点分析: 考点1:盐类水解 试题属性

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2014-2015学年浙江省六校高三3月联考理综化学试卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸。则下列判断正确的是

A.元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关
B.由于键能EH-R>EH-T,故元素R、T对应气态氢化物的沸点:HR>HT
C.R与Q的电子数相差16
D.最高价氧化物对应的水化物的酸性:X<T<Q
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:填空题
(15分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。

(1)T的原子结构示意图是______。用化学方程式表示工业上常用于冶炼T单质的原理是_________。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中的共价键类型是________ 。
(3)元素的非金属性:Q________W(填“强于”或“弱于”),结合方程式简述其原因是__________ _。
(4)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸、碱、盐都是电解质 B.电解质都是易溶于水的物质
C.氧化物都是电解质 D.氢化物都不是电解质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三3月月考理综化学试卷(解析版) 题型:实验题
(16分)CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。
方法一 铜粉还原CuSO4溶液

已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl-  [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)将废铜板浸入热的H2SO4溶液中,并通入空气,可以生成CuSO4。该反应的离子方程式为 。
(2)①中,“加热”的目的是 ,当观察到 现象,即表明反应已经完全。
(3)②中,加入大量水的作用是 。
(4)潮湿的CuCl在空气中易发生水解和氧化。上述流程中,为防止水解和氧化所添加的试剂或采取的操作是 。
方法二 铜电极电解饱和食盐水(实验装置如图)

(5)阳极的电极反应式为 。
(6)实验开始时,阳极附近没有产生CuOH沉淀的原因是 。
(已知:Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
[化学一物质结构与性质)(13分)
I.镁条在空气中燃烧主要发生以下三个反应:
2Mg+O2 2MgO 3Mg+N2
2MgO 3Mg+N2 2Mg3N2 2Mg+CO2
2Mg3N2 2Mg+CO2 2MgO+C
2MgO+C
(1)基态氮原子核外电子的轨道表示式为 .
(2)上述三个反应中所涉及的非金属元素.的第一电离能由大到小的顺序为 。
(3)MgO的晶体结构模型如图所示,若MgO晶体密度为ρg/cm3,图示中O2-与O2-的核间距a= .

Ⅱ.Mg3N2溶于水发生反应:Mg3N2+8H2O=3Mg(OH)2↓+2NH3·H2O
(4)氨水中各种微粒间不涉及的作用力是 (填选项序号)。
A.离子键
B.共价键
C.配位键
D.金属键
E.氢键
F.范德华力
(5)在一定条件下将NH气与CO2混合可制得尿素[CO(NH2)2],尿素分子中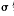 键的数目为 。
键的数目为 。
(6)向硫酸铜溶液中逐渐通入过量氨气,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。关于该晶体下列说法中正确的是 。
A.加入乙醇的目的是降低溶剂的极性,促使[Cn(NH3)4]SO4晶体析出
B.该配合物晶体中,N是配位原子,NH3为三角锥型,配位数是4
C.配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化
D.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:选择题
四种短周期元素在周期表中的相对位置如下图所示,其中Y为空气中含量最大的元素。下列叙述合理的是

A.元素W位于第三周期第ⅦA族
B.Y、Z都是植物必需的元素
C.原子半径:W>Z>Y>X
D.X氧化物的大量排放导致化学烟雾
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.HOCH2COOH的缩聚物是
B.乙醛和丙烯醛( )不是同系物
)不是同系物
C.已知甲醛分子中各原子共平面,则丙烯醛所有原子一定共平面
D.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:实验题
(19分)根据侯德榜提出的工艺,制碱厂设计生产流程如下:

(1)该流程中可循环利用的物质是 。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是 。
(3)某学习小组在实验室模拟制碱有关工艺。
①若利用氯化铵和熟石灰制取氨气,反应方程式是 ,制得的氨气可用下列盛有NaCl溶液的 装置吸收。

②已知用饱和NaNO2与NH4C1溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置:
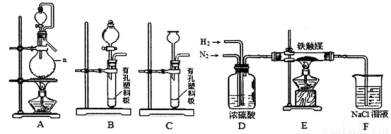
仪器a的名称是 ;氢气的发生装置应选用 ;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。装置D的作用是①除去N2、H2中的水;② ;③观察并调节气泡速率,控制N2、H2的比例。
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com