

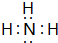 ,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
| ||
| △ |
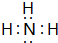 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 4-2×2 |
| 2 |
| ||
| ||


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明:
钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明:| 性状 | 本品为白色片 |
| 贮藏 | 密封,干燥处保存 |
| 规格 | 每片含碳酸钙0.5g(相当于钙0.2g) |
| 包装 | |
| 生产批号 | |
| 生产日期 | |
| 有效期至 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、50% |
| C、60% | D、70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、葡萄糖能发生氧化反应和水解反应 |
| D、蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [B] |
| [OH-] |
| [OH-] |
| [H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I- NO3- SiO32- H+ |
| B、K+ Fe3+ Cl- SO42- SCN- |
| C、K+ AlO2- SO42- NO3- |
| D、NH4+ OH- Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
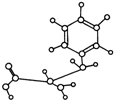
| A、能与NaOH发生反应,但不能与盐酸反应 |
| B、能合成高分子化合物 |
| C、能发生加成反应 |
| D、能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
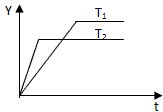 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com